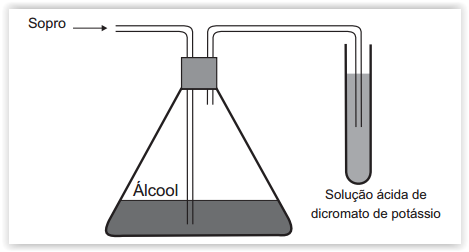
A glicose, na presença de enzimas, passa por um processo de fermentação, no qual açúcares são quimicamente convertidos em
Duas garrafas pet de 500 mL tiveram o fundo retirado e foram
encaixadas, formando um tubo, como mostrado na figura.
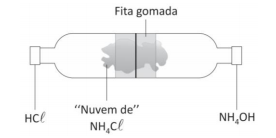
Em uma das tampas foi colocado um algodão embebido em ácido
clorídrico (HCL) e, na outra, um algodão embebido em hidróxido
de amônio (NH4OH). As tampas foram atarraxadas e, em alguns
segundos, os alunos foram surpreendidos com a formação de
uma “nuvem" esbranquiçada, próximo ao centro da montagem.
O professor explicou que a nuvem correspondia a uma espécie de
poeira de cloreto de amônio (NH4CL).
O experimento pode ser utilizado para demonstrar uma reação
de
Um bafômetro simples consiste em um tubo contendo uma mistura sólida de dicromato de potássio em sílica umedecida com ácido sulfúrico. Nesse teste, a detecção da embriaguez por consumo de álcool se dá visualmente, pois a reação que ocorre é a oxidação do álcool a aldeído e a redução do dicromato (alaranjado) a cromo(III) (verde) ou cromo(II) (azul).
A equação balanceada da reação química que representa esse teste é:
Na preparação da massa do pão, presente na mesa do café da maioria dos brasileiros, utiliza-se o fungo Saccharomyces cerevisiae vivo, contido no fermento. Sua finalidade é fazer com que a massa cresça por meio da produção de gás carbônico.
Esse processo químico de liberação de gás é causado pela
Os métodos empregados nas análises químicas
são ferramentas importantes para se conhecer a
composição dos diversos materiais presentes no meio
ambiente. É comum, na análise de metais presentes
em amostras ambientais, como água de rio ou de
mar, a adição de um ácido mineral forte, normalmente
o ácido nítrico (HNO3), com a finalidade de impedir a
precipitação de compostos pouco solúveis desses
metais ao longo do tempo.
Na ocorrência de precipitação, o resultado da análise
pode ser subestimado, porque
O cianeto de sódio, NaCN, e um poderoso agente complexante, usado em laboratórios químicos e em indústria de extração de ouro.
Quando uma indústria lança NaCN solido nas águas de um rio, ocorre o seguinte equilíbrio químico:

Esse equilíbrio químico é decorrente de uma reação de
Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).
CaCO3(s) + SO2 (g) à CaSO3 (s) + CO2 (g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa e de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 Ca SO3 (s) + O2 (g) à 2 CaSO4 (s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cáclcio são iguais a 12g/mol, 16g/mol, 32g/mol e 40g/mol, respectivamente.
BAIRD, C. Química Ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
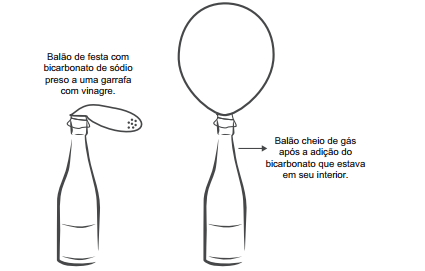
A transformação química em questão é representada pela equação:
Um filme fotográfico consiste em uma fina película transparente revestida com uma gelatina incolor contendo inúmeros cristaizinhos de um haleto de prata. São os íons Ag presentes nesses sais que desempenham papel fundamental no processo. Como o brometo de prata é muito utilizado, vai-se representar o processo fotográfico, considerando que o haleto presente no filme seja o AgBr. No momento em que o objeto é fotografado, a luz atinge o filme e provoca a reação abaixo:
2Ag+ + 2Br- 2Ag0 + Br2 0
Essa equação pode ser classificada como:
Uma das etapas do tratamento da água é a desinfecção, sendo a cloração o método mais empregado. Esse método consiste na dissolução do gás cloro numa solução sob pressão e sua aplicação na água a ser desinfetada. As equações das reações químicas envolvidas são:
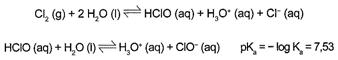
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de:
O mármore é um material empregado para revestimento de pisos e um de seus principais constituintes é o
carbonato de cálcio. Na limpeza desses pisos com solução ácida, ocorre efervescência.
Nessa efervescência o gás liberado é o
Uma reação de oxidação do ácido acético com permanganato de potássio em meio ácido fornece como produtos sulfato de potássio, sulfato de manganês (II), dióxido de carbono e água. Na equação que representa essa reação balanceada com os menores coeficientes estequiométricos inteiros, o coeficiente estequiométrico da água é
Para preparar uma massa básica de pão, deve–se
misturar apenas farinha, água, sal e fermento. Parte do
trabalho deixa–se para o fungo presente no fermento: ele
utiliza amido e açúcares da farinha em reações químicas
que resultam na produção de alguns outros compostos
importantes no processo de crescimento da massa. Antes
de assar, é importante que a massa seja deixada num
recipiente por algumas horas para que o processo de
fermentação ocorra.
Esse período de espera é importante para que a massa
cresça, pois é quando ocorre a
Uma amostra de mármore foi mergulhada em uma solução de ácido muriático e, após alguns segundos, observou-se a formação de um gás. Na tentativa de conhecer a identidade desse gás, um experimentador borbulhou-o em uma solução A e observou a formação de um precipitado. As identidades do gás, liberado na reação descrita, e da solução A, responsável pela formação do precipitado, são, respectivamente:
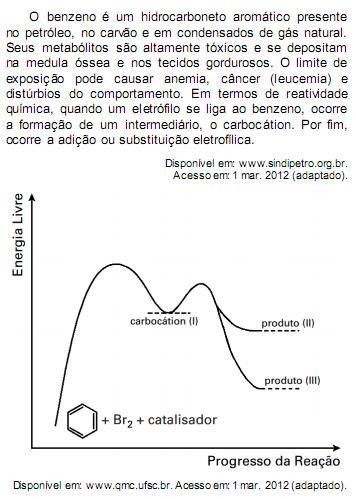
Com base no texto e no gráfico do progresso da reação apresentada, as estruturas químicas encontradas em I, II e III são, respectivamente: