Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para
ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
As diferentes reações químicas inorgânicas são classificadas de acordo com o reposicionamento dos átomos presentes nas substâncias envolvidas na reação. Observe a reação seguir:
O exemplo descrito é classificado como uma reação de:
O odor que permanece nas mãos após o contato com alho pode ser eliminado pela utilização de um “sabonete de aço inoxidável”, constituído de aço inox (74%), cromo
e níquel. A principal vantagem desse “sabonete” é que ele não se desgasta com o uso. Considere que a principal substância responsável pelo odor de alho é a alicina (estrutura I) e que, para que o odor seja eliminado, ela seja transformada na estrutura II.
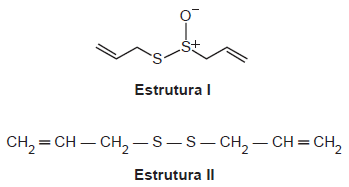
Na conversão de I em II, o “sabonete” atuará como um
O 2,4-dinitrofenol (DNP) é conhecido como desacoplador da cadeia de elétrons na mitocôndria e apresenta um efeito emagrecedor. Contudo, por ser perigoso e pela ocorrência de casos letais, seu uso como medicamento é proibido em diversos países, inclusive no Brasil. Na mitocôndria, essa substância captura, no espaço intermembranas, prótons (H+) provenientes da atividade das proteínas da cadeia respiratória, retornando-os à matriz mitocondrial. Assim, esses prótons não passam pelo transporte enzimático na membrana interna.
GRUNDLINGH, J. et al. 2,4-Dinitrophenol (DNP): a Weight Loss Agent with Significant Acute Toxicity and Risk of Death. Journal of Medical Toxicology, v. 7, 2011 (adaptado).
O efeito emagrecedor desse composto está relacionado ao(à)
Antigamente, em lugares com invernos rigorosos, as pessoas acendiam fogueiras dentro de uma sala fechada para se aquecerem do frio. O risco no uso desse recurso ocorria quando as pessoas adormeciam antes de apagarem totalmente a fogueira, o que poderia levá-las a óbito, mesmo sem a ocorrência de incêndio.
A causa principal desse risco era o(a)
Um teste de laboratório permite identificar alguns cátions metálicos ao introduzir uma pequena quantidade do material de interesse em uma chama de bico de Bunsen para, em seguida, observar a cor da luz emitida.
A cor observada é proveniente da emissão de radiação eletromagnética ao ocorrer a
Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo.
O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, KI), conforme mostrado na imagem.
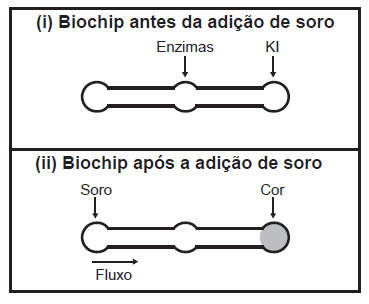
Após a adição de soro sanguíneo, o fluxo desloca-se espontaneamente da esquerda para a direita (ii) promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio:

O tipo de reação que ocorre na superfície do biochip, nas duas reações do processo, é
Nas aulas práticas de química inorgânica, geralmente são realizadas sínteses químicas de um determinado material com uma estrutura mais complexa a partir de compostos mais simples. Foi realizada a seguinte síntese durante a prática de laboratório: em um béquer de 25mL, foi pesado 100mg de carbonato bário e adicionado 2mL de água. Foi adicionada, gota a gota, uma solução 6,0 mol L-1 de ácido clorídrico até que todo o sólido fosse dissolvido. A solução foi diluída para o volume final de 10mL e adicionada de duas gotas de uma solução 0,5% de vermelho de metila. Foi adicionado, então, 6,0mL de uma solução aquosa saturada de oxalato de amônio e 4,0g de uréia à mistura. O resultado da prática foram as formações de cristais. Indique a opção que apresenta o nome do composto obtido após a finalização dessa síntese.
Muitas reações químicas inorgânicas podem ser classificadas em reações de síntese ou de análise ou de simples troca ou de dupla troca. Nesse contexto, relacione a COLUNA II com a COLUNA I, classificando as reações químicas.
COLUNA I
- Reação de síntese
- Reação de análise
- Reação de simples troca
- Reação de dupla troca
COLUNA II
( ) 3 H2(g) + N2(g)→2 NH3(g)
( ) NaCl + AgNO3 → AgCl + NaNO3
( ) 2 NaN3(s) → 3 N2(g) + 2 Na(s)
( ) 2 Fe(s) + 6 HCl(aq)→2 FeCl 3(aq) + 3 H2(g)
Assinale a sequência correta.
As diferentes reações químicas inorgânicas são classificadas de acordo com o reposicionamento dos átomos presentes nas substâncias envolvidas na reação. Observe a reação seguir:
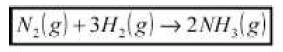
O exemplo descrito é classificado como uma reação de:
Afigura apresenta um processo alternativo para obtenção de etanol combustível, utilizando o bagaço e as folhas da cana-de-açúcar. Suas principais etapas são identificadas com números.
Em qual etapa ocorre a síntese desse combustível?
A importância econômica e tecnológica desses elementos, pela similaridade de suas propriedades químicas e físicas, deve-se a
A oxidação do ferro para a formação de ferrugem envolve várias etapas, mas pode ser descrita, de maneira simplificada, da seguinte forma:
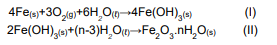
A esse respeito, assinale a alternativa correta.
Questão anterior:
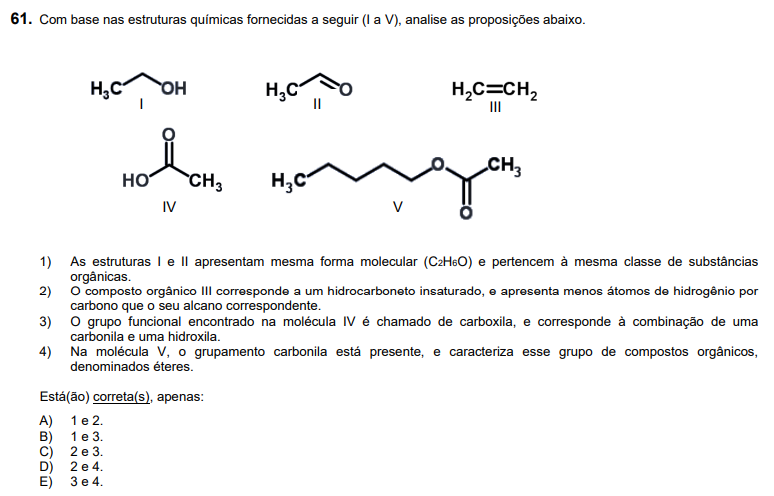
Ainda com base nos compostos orgânicos (I a V) apresentados na questão 61, com relação às diferentes reações orgânicas, assinale a alternativa correta.
Os exemplos de substâncias incompatíveis com a água são:




