O texto a seguir foi adaptado de Quim. Nova, v. 39, 732-
740, 2016
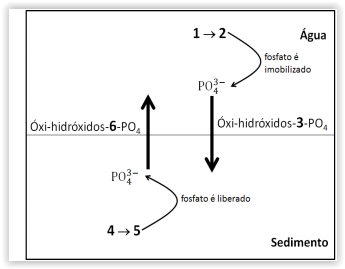
“Nos ambientes aquáticos, a concentração de fosfatos na
coluna de água é dependente de alguns fatores, como o par
redox Fe(II)/Fe(III), uma vez que nas camadas superficiais
sua associação com os oxi-hidróxidos de Fe(III) formam
compostos que apresentam baixa solubilidade e migram
para camadas mais profundas (sedimento). Nessas camadas
os oxi-hidróxidos de Fe(II), mais solúveis que os
compostos de Fe(III, são formados, com a liberação do
fosfato, estabelecendo um ciclo onde o fósforo migra
novamente para as camadas superficiais."
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Considerando-se a eletrólise do AlCl3 fundido, em que se empregou uma corrente elétrica de 6 A durante 600 segundos, assinalar a alternativa CORRETA:
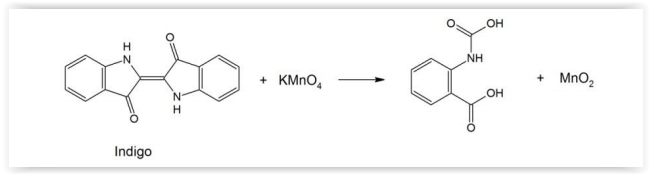
O jeans com aspecto “desbotado" pode ser obtido pela oxidação parcIal do índigo impregnado no tecido (denim),
utilizando-se uma solução de KMnO4, como ilustrado pelo esquema reacional a seguir. Devido à formação de MnO2, sólido
castanho insolúvel em água, um outro reagente deve ser usado para que ele não impregne o tecido.
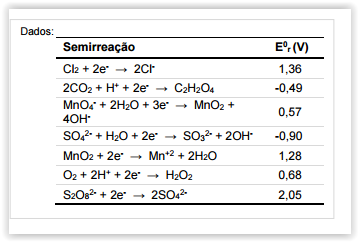
De acordo com os potencIais de redução fornecidos na tabela
ao lado, assinale a alternativa que apresenta substâncIas que
podem ser usadas para transformar o MnO2 na espécie
solúvel Mn+2
As técnicas eletroanalíticas se baseiam em processos de ________onde as espécies eletroativas do meio oferecem resposta à aplicação de um _______para o monitoramento da corrente elétrica ou valor do potencial em comparação ao potencial de um eletrodo de referência. A ________e a _______são bastante utilizadas em análises de espécies eletroativas orgânicas e inorgânicas e na determinação seletiva de íons orgânicos e inorgânicos em solução, respectivamente. Assinale a alternativa que corresponde as palavras CORRETAS para cada respectivo espaço vazio.
O professor propôs, como introdução ao estudo das reações de
oxirredução, um experimento bem simples para que o aluno
tenha condições de observar um fenômeno que envolve
mudanças visuais muito nítidas desse tipo de reação.
No experimento, o aluno deve acrescentar um comprimido de
vitamina C não efervescente a uma solução de iodo
(farmacêutica) e adicionar água. Nessa reação a vitamina C que é
oxidada promove um descoramento da solução de iodo que é
reduzido.
A transformação que ocorre no iodo pode ser codificada em uma
linguagem química como
A quantidade de matéria orgânica em águas superficiais e
residuais pode ser expressa por meio da demanda química de
oxigênio (DQO).
A principal reação para estimar o teor de material orgânico em
águas pode ser representada como:
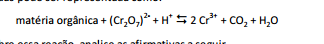
Sobre essa reação, analise as afirmativas a seguir.
I. A matéria orgânica é reduzida formando CO2.
II. O dicromato atua como agente oxidante.
III. O dicromato doa elétrons para a matéria orgânica formarCO2.
Está correto o que se afirma em
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
O tempo necessário para a formação de 709 g de Cl2, a partir
da eletrólise da solução aquosa de NaCL, é superior a 2 h.
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
Na eletrólise da solução aquosa de NaCR, a formação do Cl2
ocorre no ânodo da célula.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Na proteção com metal de sacrifício, o material a ser protegido
é conectado como ânodo de uma célula galvânica, sendo o
cátodo um metal mais ativo que se consome à medida que
protege o material.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Há casos benéficos de corrosão, como a oxidação de aços
inoxidáveis, que produz uma camada protetora de óxido de
cromo, e a proteção do material de alumínio, com a formação
de óxido de alumínio.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Considerando os potenciais de oxidação mostrados a seguir, é
correto afirmar que a limpeza de aço inoxidável com cloro
pode ser recomendada por impedir a corrosão devido ao menor
potencial de oxidação (E) do ferro (Fe) em relação ao cloro
(Cl).
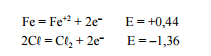
A hidrazina, N2 H4 , na forma líquida, usada como combustível, é carregada em um dos tanques de um foguete. Para que o foguete seja impulsionado, deve ocorrer a reação com oxigênio, O2 , também na forma líquida, presente em um outro tanque do foguete. A reação ocorre numa câmara, logo acima dos propulsores, na proporção de 1 mol de N2 H4 para 1 mol de O2 , gerando dois produtos, sendo um deles o gás nitrogênio, N2 . Considerando-se que um foguete carrega 3.200 kg de hidrazina, a massa mínima de oxigênio, em kg, que o foguete tem de levar, de modo a reagir com toda a hidrazina existente, e o segundo produto da reação são, respectivamente,
O uso crescente de fibras ópticas para a construção de redes de
telecomunicações em banda larga levou a avanços consideráveis
na tecnologia da fabricação de vidros (...). Os vidros têm estrutura
em rede baseada em um óxido de ametal, normalmente a sílica
(SiO2), fundida juntamente com óxidos de metais que agem como
“modificadores de rede" e alteram o arranjo das ligações do
sólido (...). O vidro resiste ao ataque da maior parte dos
reagentes. Entretanto, a sílica do vidro reage com ácido
fluorídrico para formar íons fluoro‐silicatos:

Na reação apresentada
Alumínio metálico pode ser produzido eletroliticamente pelo processo Hall-Heroult em que o A603 é dissolvido em criolita fundida, Na3AiF6.
Nesse processo o Ion alumínio é reduzido a alumínio metálico e o ion 02 é oxidado a 02, que reage com os anodos de carbono gerando CO2.
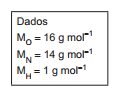
A massa de aluminio obtida nessa eletrolise por uma corrente de 8,0A durante 3 horas e 20 minutos e rendimento de 100%, é de:
Dados: Massa molar (g.mor-1): Ai= 27 1F = 96500C
Um filme fotográfico consiste em uma fina película transparente revestida com uma gelatina incolor contendo inúmeros cristaizinhos de um haleto de prata. São os íons Ag presentes nesses sais que desempenham papel fundamental no processo. Como o brometo de prata é muito utilizado, vai-se representar o processo fotográfico, considerando que o haleto presente no filme seja o AgBr. No momento em que o objeto é fotografado, a luz atinge o filme e provoca a reação abaixo:
2Ag+ + 2Br- 2Ag0 + Br2 0
Essa equação pode ser classificada como: