O processo não espontâneo, em que a passagem de uma corrente elétrica através de um sistema líquido, no qual existam íons, produz reações químicas é conhecido como eletrólise.
A eletrólise de uma solução aquosa de NaCl, produz soda cáustica e dois gases que são:
O boro-hidreto é um agente redutor útil, pois a semirreação
esquematizada a seguir, apresenta baixo potencial de redução:
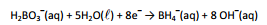
O íon boro-hidreto pode ser utilizado na deposição de níquel a
partir de uma solução contendo Ni2+.
A reação entre o íon boro-hidreto e o Ni2+ ocorre
A célula eletroquímica hipotética, representada por
X (s) │ X2+ (1,00 mol.L–1) ││ Cu2+ (0,01 mol.L–1) │ Cu (s)
apresentou potencial igual 0,686 volts.
Esta célula hipotética foi construída por duas semi‐células, uma
formada por um eletrodo desconhecido imerso em uma solução
de concentração 1,00 mol.L–1 contendo seus cátions X´2+ e outra
formada por um eletrodo de cobre imerso em uma solução
diluída com íons Cu2+ na concentração 0,01 mol.L–1.
Nas condições do enunciado, os eletrodos apresentam os
potenciais padrão:
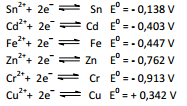
Nestas condições, X é o
O escurecimento de objetos de prata, como baixelas e talheres, é muito comum. Ao se cozinhar demasiadamente os ovos, as proteínas da clara, que contêm átomos de enxofre, liberam o ácido sulfídrico, que na forma gasosa e na presença de oxigênio, na água de cozimento, pode levar à oxidação do objeto de prata, com formação de uma fina camada insolúvel de sulfeto de prata (Ag 2S). O mesmo ocorre quando se cozinham alimentos como o repolho, que contém compostos sulfurados como a cisteína, estrutura representada na figura, que sofre decomposição durante o cozimento, liberando o H2S. As principais reações envolvidas nesse fenômeno são apresentadas nas equações:
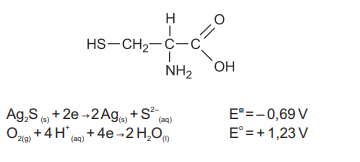
A diferença de potencial (ddp) para a reação global que representa o fenômeno do escurecimento dos objetos de prata tem valor igual a:
Busca-se construir uma pilha que apresente diferença de potencial teórica em torno de ΔE = +2,5V. Considere a tabela de potenciais de redução, apresentada a seguir.
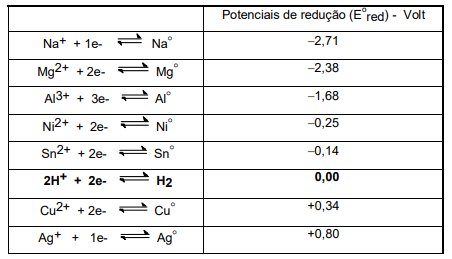
Indique a alternativa que descreve a reação química adequada para produzir a referida pilha.
Uma aplicação usual de eletrólise ígnea na indústria é
aquela em que se obtém alumínio a partir do Al23 .
Qual é a corrente elétrica necessária, em ampère, para
depositar no catodo uma massa igual a 2,7 g de alumínio
em 2 horas?
Dado: Carga do elétron: 1,6 x 10-19 C
Constante de Avogadro = 6 x 1023
Dicromato de potássio em solução aquosa e em meio ácido
pode ser utilizado como padrão na determinação de
peróxido de hidrogênio em análises de amostras de água
oxigenada, de acordo com a equação incompleta abaixo.
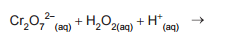
Sobre a reação acima, analise as afirmações a seguir.
I - H2(g) é um dos produtos da reação.
II - O2(g) é um dos produtos da reação.
III - Cr2 O7 2- é o agente redutor, pois cede elétrons ao H + .
IV - H2 O2 é o agente oxidante, pois ganha elétrons do Cr2 O7 2- .
Está correto APENAS o que se afirma em
Um dos bafômetros utilizados para medir a quantidade de
etanol (CH3 CH2 OH) exalado pelos motoristas é baseado
na oxidação do etanol com uma solução ácida de dicromato (Cr2 O7 2- ) a 25°C. Na medição, a cor da solução
muda de laranja, característico do Cr2 O7 2- , para o verde do Cr3+. A mudança de cor, que é um processo de transferência de elétrons espontâneo, indica a presença de álcool
no sangue.
A esse respeito, considere as semirreações abaixo.
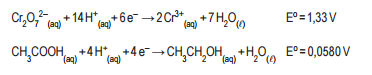
O valor do potencial padrão desse sistema é

