O estado de Santa Catarina possui diversas indústrias de fabricação de vidros. Para a obtenção desse importante material inorgânico usam-se diversas matérias-primas que necessitam passar por um processo de transformação química. Com relação a produção de vidros e suas propriedades marque V para as afirmativas verdadeiras e F, para as falsas.
( ) O vidro apresenta estrutura cristalina, ou seja, possui estrutura molecular ordenada a longo alcance.
( ) O carbonato de cálcio é uma matéria-prima natural usada para produzir vidros soda-cal, como o vidro de janela.
( ) A Albita é um feldspato sintético responsável por incorporar ao vidro óxidos de elementos alcalinos e alcalinos terrosos, como o sódio e o potássio.
( ) Para se conformar vidros pode-se usar um processo chamado de recozimento.
( ) Quando há necessidade de formular vidros com baixa expansão térmica linear pode-se usar baixos percentuais de sílica e altos percentuais de óxido de boro.
( ) O processo de têmpera térmica é realizado em vidros com o objetivo de incrementar a resistência mecânica.
( ) Como exemplos de óxidos formadores de vidro pode-se citar o SiO 2 e o AI2O3, e como exemplos de óxidos fundentes pode-se citar o Na2O e o Li2O
Assinale a alternativa que contém a sequência CORRETA de cima para baixo.
Um dos casos em que a reciclagem proporciona grande economia de energia é no reaproveitamento do alumínio. Em tempos em que a ameaça de escassez de energia elétrica compromete a crescimento do país e exige uma mudança de hábitos da população com o objetivo de evitar a pior, é importante destacar o papel da reciclagem. Assinale a alternativa INCORRETA:
A configuração eletrônica do átomo de Flúor que possui Z = 9 e A= 19 é apresentada na alternativa:
Assinale a alternativa que possui um exemplo de óxido ácido.
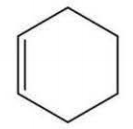
Sobre o composto orgânico a seguir pode-se afirmar que sua cadeia é classificada como:
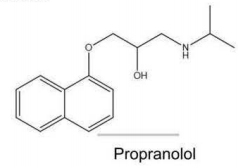
O propranolol é uma molécula empregada para o tratamento de problemas cardíacos. A estrutura desta molécula apresenta os grupos funcionais representativos das funções orgânicas indicadas na alternativa:
Sobre a utilização e propriedades de criogênicos em um espectrômetro de Ressonância Magnética Nuclear, assinale V, para verdadeiro, e F, para falso, nas afirmativas a seguir:
( ) Hélio e nitrogênio são os criogênicos empregados, apresentando temperaturas de ebulição de -269 oC e -196 oC, respectivamente.
( ) Emprega-se o nitrogênio como criogênico exclusivamente para desacelerar a taxa de evaporação do criogênico hélio.
( ) Os principais riscos associados ao manuseio dos criogênicos são: perigo para a respiração, perigo de queimaduras pelo frio e perigos de expansão.
( ) Durante a sua transferência, o contentor de hélio líquido é pressurizado pelo nitrogênio gasoso por ser este mais acessível e de menor custo que o hélio gasoso.
Assinale a alternativa que apresenta a sequência CORRETA de V e F de cima para baixo:
Existem vários tipos de extintores para uso em diferentes classes de incêndio. Os principais deles são: o extintor de pó químico (NaHCO3), que age por abafamento, interrompendo a combustão; o extintor de gás carbônico (CO2), que age por abafamento e resfriamento; o extintor de água (H2O), que age por resfriamento e, em parte, por abafamento; e o extintor de espuma mecânica, que age por abafamento e por resfriamento.
Com relação ao funcionamento desses tipos de extintores e aos seus componentes químicos, julgue os itens a seguir.
No texto, são apresentadas fórmulas que contêm átomos de elementos químicos de não metal e de um metal de transição.
Existem vários tipos de extintores para uso em diferentes classes de incêndio. Os principais deles são: o extintor de pó químico (NaHCO3), que age por abafamento, interrompendo a combustão; o extintor de gás carbônico (CO2), que age por abafamento e resfriamento; o extintor de água (H2O), que age por resfriamento e, em parte, por abafamento; e o extintor de espuma mecânica, que age por abafamento e por resfriamento.
Com relação ao funcionamento desses tipos de extintores e aos seus componentes químicos, julgue os itens a seguir.
Quando em funcionamento, o extintor de espuma facilita o contato do comburente com o combustível.
Uma mistura sólida de 0,300 g, constituída exclusivamente de carbonato de sódio e cloreto de sódio, foi dissolvida em água e a esta solução foram acrescentados 40,00 mL de ácido clorídrico 0,100 mol/L. Sabendo que o volume de ácido clorídrico adicionado foi suficiente para provocar a liberação de todo o possível CO2 proveniente da mistura sólida, assinale a alternativa que apresenta a porcentagem em massa de carbonato de sódio presente na mistura original. (Dados: Massas molares: Na = 23 g/mol; C = 12 g/mol; Ca = 40 g/mol; K = 39 g/mol; O = 16 g/mol; Cl = 35,5 g/mol).
No laboratório de uma escola pública, um estudante do Ensino Médio dissolveu 0,4 mol de um monoácido HA em 1,0 L de água destilada. Sabendo que a constante de ionização da base A- é 4,0x10-11, a 25 ºC, assinale a alternativa que apresenta o correto valor do pH, a 25ºC, da solução preparada pelo referido estudante.
Adicionar formal em produtos para alisamento capilar é uma prática proibida pela Agência Nacional de Vigilância Sanitária (Anvisa). A adição de glutaral também é proibida, pois, devido à sua semelhança química com o formal, apresenta os mesmos riscos e restrições. Os princípios ativos desses materiais são apresentados:
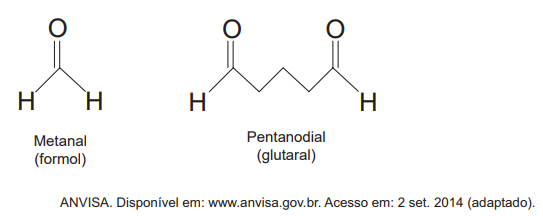
Esses princípios ativos apresentam propriedades químicas semelhantes, pois possuem

A ação exercida pelo potássio nessas partes do corpo é o(a)
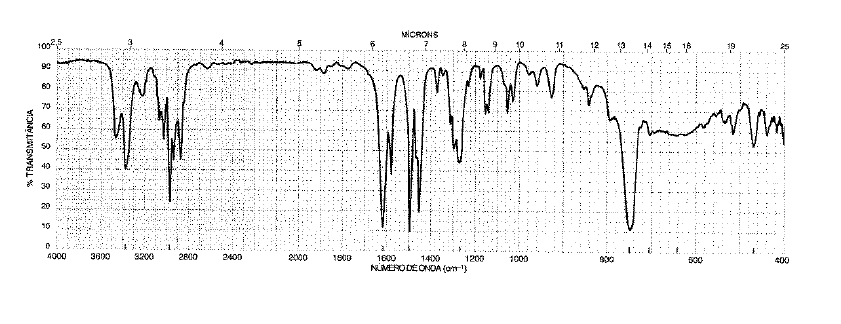
Determine a estrutura da substância desconhecida baseando-se no seu espectro infravermelho (IV) apresen-tado.
O grupo das angiospermas representa grande parte das plantas do planeta e pela sua diversidade de características vegetativas e florais é frequentemente utilizado pelos seres humanos como ornamentação de ambientes. Sobre este grupo de plantas, assinale a alternativa FALSA.