Acerca da termoquímica, julgue os itens subsequentes.
O valor calorífico de um combustível é medido a partir do calor de absorção que ele apresenta.
No contexto a que se refere o fragmento de texto anterior, a energia vibracional é
Considere o diagrama de energia para a reação X + Y → Z.
Os intervalos I, II e III representam, correta e respectivamente,
A combustão tem sua origem quando uma energia de ignição é fornecida para um sistema formado por um composto que atua como combustível e um composto que atua como comburente, normalmente o gás oxigênio.
Sobre as reações de combustão, assinale a alternativa correta.
A respeito dos conceitos de equilíbrio químico, entalpia, entropia e energia livre, assinale a alternativa correta.
A gasolina, combustível largamente utilizado pela população mundial, é constituída majoritariamente de octano, um composto classificado como hidrocarboneto. Considerando que 1 mol de octano libera aproximadamente 5400 kJ, determine a massa de CO2 que será formada numa reação de combustão do octano que libera 323 kcal.
Dados das massas molares em g.mol-1 : C = 12 e O = 16.
O gás de cozinha é fundamentalmente composto pelos gases propano (C3H8) e butano (C4H10), a queima deste gás está sendo usada para aquecer 3,60 Kg de água. Qual a quantidade de calor (q) absorvida pela água sabendo-se que um mol do gás elevou a temperatura da água de 25ºC para 78,7ºC
Dados: calor específico da água (c) = 4,18 J/goC.
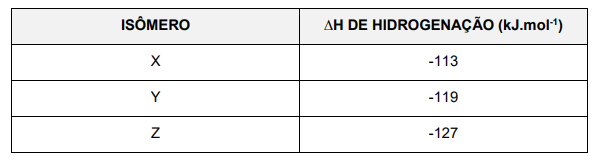
O metilbutano pode ser obtido a partir da hidrogenação catalítica, em fase gasosa, de alguns alcenos que são isômeros planos entre si. A tabela a seguir apresenta os isômeros de posição, denominados X, Y e Z, e seus respectivos valores hipotéticos de entalpia da reação de hidrogenação:
Sobre esses isômeros, é correto afirmar que
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
A quantidade de calor que é absorvida ou liberada por um sistema durante uma variação independe de como a variação ocorre.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
Grande parte dos processos químicos é conduzida à pressão constante ou quase constante. Com isso, o calor absorvido em uma reação é igual à soma do aumento na energia do sistema com qualquer trabalho realizado sobre o sistema.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
A termoquímica é o ramo da química sobre a relação entre calor e transformações químicas. A quantidade de calor liberado ou absorvido em um sistema reagente depende da natureza da reação, das quantidades dos reagentes e das condições impostas na mistura reagente.
O metanol líquido pode ser obtido a partir da reação de síntese entre monóxido de carbono e gás hidrogênio. As entalpias de formação das substâncias citadas são, respectivamente, -238,4 kJ.mol-1 e -110,5 kJ.mol-1 .
O valor da variação de entropia da vizinhança desse sistema a 25°C, em J.K-1, é:
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
Um processo endotérmico ocorre com absorção de calor (ΔH < 0), como, por exemplo, no processo de congelamento da água. Um processo exotérmico ocorre com liberação de calor (ΔH > 0), como, por exemplo, no processo de vaporização da água.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
Quando uma reação química se realiza à pressão constante, a quantidade de calor liberado ou absorvido é expressa pela variação da entalpia do sistema. Seu sinal algébrico indica se a reação é endotérmica ou exotérmica.
Assinale a opção correta com relação a soluções, termoquímica e cinética química.