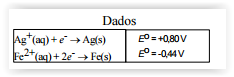
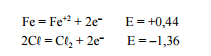Qual o potencial da célula, em V, para o processo
eletroquímico no qual o ferro pode reduzir os íons prata?
Com relação à corrosão, analise as afrmativas. I. Na corrosão eletroquímica, os elétrons são cedidos em determinada região e recebidos em outras, aparecendo uma pilha de corrosão. II. Os aços inoxidáveis sofrem corrosão. III. O ácido sulfúrico concentrado é mais corrosivo que o mesmo ácido diluído. Está correto o que se afrma em:
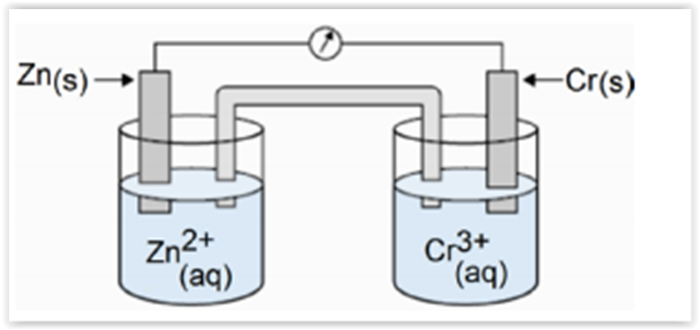
Uma pilha é definida como um equipamento que consegue converter energia química em energia elétrica. Para isso,
ela precisa conter dois eletrodos, o cátodo e o ânodo, formados por diferentes metais, por onde os elétrons irão fluir,
gerando a corrente elétrica. Diante do exposto, considerar a pilha galvânica apresentada na figura abaixo:
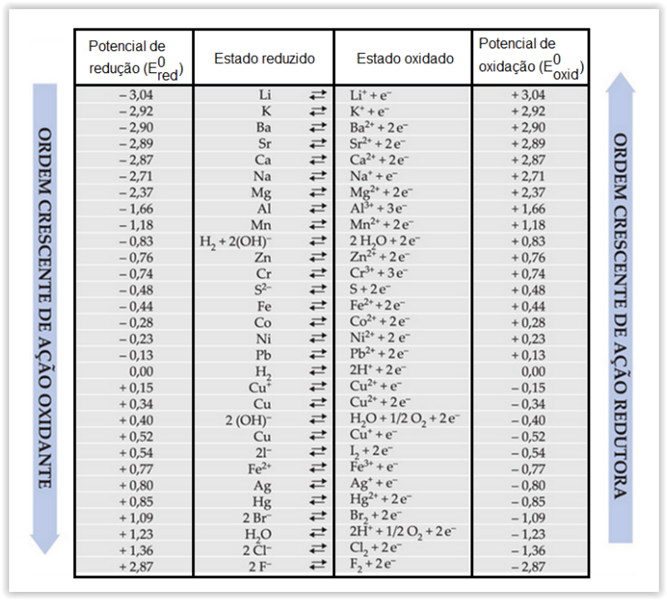
Considerando-se também a tabela de potenciais-padrão de redução, apresentados na tabela abaixo em V, assinalar a
alternativa que apresenta a força eletromotriz desse sistema em mV:
Com base nos conceitos de eletroquímica e de radioquímica,
julgue os próximos itens.
Agente oxidante é uma espécie que fornece elétrons a uma substância que está sendo reduzida (e ela própria sendo oxidada) em uma reação de oxirredução. Agente redutor é a espécie que remove elétrons da espécie que está sendo oxidada (e ele próprio é reduzido) em uma reação de oxirredução.
O texto a seguir foi adaptado de Quim. Nova, v. 39, 732-
740, 2016
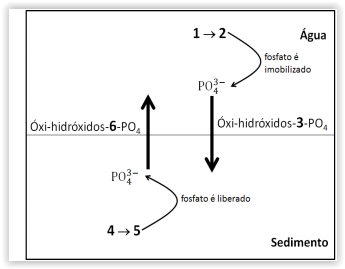
“Nos ambientes aquáticos, a concentração de fosfatos na
coluna de água é dependente de alguns fatores, como o par
redox Fe(II)/Fe(III), uma vez que nas camadas superficiais
sua associação com os oxi-hidróxidos de Fe(III) formam
compostos que apresentam baixa solubilidade e migram
para camadas mais profundas (sedimento). Nessas camadas
os oxi-hidróxidos de Fe(II), mais solúveis que os
compostos de Fe(III, são formados, com a liberação do
fosfato, estabelecendo um ciclo onde o fósforo migra
novamente para as camadas superficiais."
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Considerando-se a eletrólise do AlCl3 fundido, em que se empregou uma corrente elétrica de 6 A durante 600 segundos, assinalar a alternativa CORRETA:
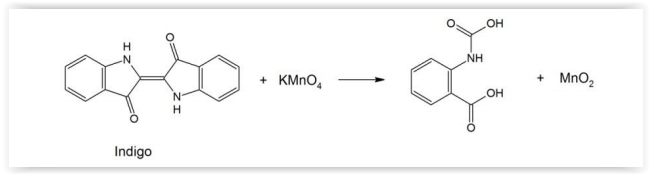
O jeans com aspecto “desbotado" pode ser obtido pela oxidação parcIal do índigo impregnado no tecido (denim),
utilizando-se uma solução de KMnO4, como ilustrado pelo esquema reacional a seguir. Devido à formação de MnO2, sólido
castanho insolúvel em água, um outro reagente deve ser usado para que ele não impregne o tecido.
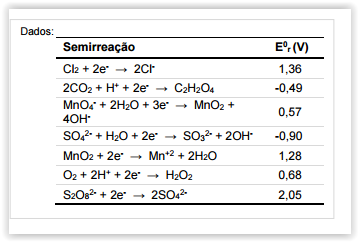
De acordo com os potencIais de redução fornecidos na tabela
ao lado, assinale a alternativa que apresenta substâncIas que
podem ser usadas para transformar o MnO2 na espécie
solúvel Mn+2
As técnicas eletroanalíticas se baseiam em processos de ________onde as espécies eletroativas do meio oferecem resposta à aplicação de um _______para o monitoramento da corrente elétrica ou valor do potencial em comparação ao potencial de um eletrodo de referência. A ________e a _______são bastante utilizadas em análises de espécies eletroativas orgânicas e inorgânicas e na determinação seletiva de íons orgânicos e inorgânicos em solução, respectivamente. Assinale a alternativa que corresponde as palavras CORRETAS para cada respectivo espaço vazio.
O professor propôs, como introdução ao estudo das reações de
oxirredução, um experimento bem simples para que o aluno
tenha condições de observar um fenômeno que envolve
mudanças visuais muito nítidas desse tipo de reação.
No experimento, o aluno deve acrescentar um comprimido de
vitamina C não efervescente a uma solução de iodo
(farmacêutica) e adicionar água. Nessa reação a vitamina C que é
oxidada promove um descoramento da solução de iodo que é
reduzido.
A transformação que ocorre no iodo pode ser codificada em uma
linguagem química como
A quantidade de matéria orgânica em águas superficiais e
residuais pode ser expressa por meio da demanda química de
oxigênio (DQO).
A principal reação para estimar o teor de material orgânico em
águas pode ser representada como:
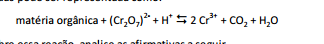
Sobre essa reação, analise as afirmativas a seguir.
I. A matéria orgânica é reduzida formando CO2.
II. O dicromato atua como agente oxidante.
III. O dicromato doa elétrons para a matéria orgânica formarCO2.
Está correto o que se afirma em
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
O tempo necessário para a formação de 709 g de Cl2, a partir
da eletrólise da solução aquosa de NaCL, é superior a 2 h.
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
Na eletrólise da solução aquosa de NaCR, a formação do Cl2
ocorre no ânodo da célula.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Na proteção com metal de sacrifício, o material a ser protegido
é conectado como ânodo de uma célula galvânica, sendo o
cátodo um metal mais ativo que se consome à medida que
protege o material.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Há casos benéficos de corrosão, como a oxidação de aços
inoxidáveis, que produz uma camada protetora de óxido de
cromo, e a proteção do material de alumínio, com a formação
de óxido de alumínio.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Considerando os potenciais de oxidação mostrados a seguir, é
correto afirmar que a limpeza de aço inoxidável com cloro
pode ser recomendada por impedir a corrosão devido ao menor
potencial de oxidação (E) do ferro (Fe) em relação ao cloro
(Cl).