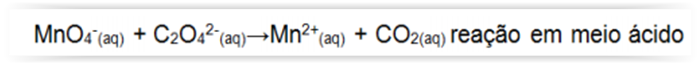A diferença de potencial entre dois eletrodos em uma célula voltaica fornece a força eletromotriz que empurra os elétrons por um circuito externo. Para uma pilha, essa força é denominada potencial da célula (E). Sob condições-padrão (concentração das soluções de 1 mol L-1, pressão 1 atm e 25 ºC), tem-se o potencial-padrão da célula (Eºcélula), que pode ser determinado pela diferença dos potenciais-padrão de redução das reações que acontecem no catodo (Eºcatodo) e anodo (Eºanodo). Sabendo que os Eº das células voltaicas Zn-Cu2+, Ni-Cu2+ e Zn-Fe2+ são +1,10, +0,62 e +0,32 V, respectivamente, assinale a alternativa que apresenta o Eº da célula voltaica Fe-Ni2+.
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
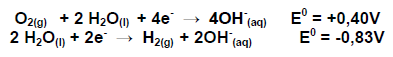
Quais substância são os agentes oxidante e redutor, respectivamente,
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
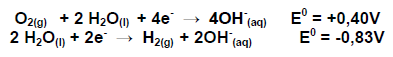
A reação global da pilha no estado padrão e seu valor do potencial padrão da pilha são, respectivamente,
A bateria de carro é um gerador de energia relativamente barato, tem uma vida útil longa e uma recarga fácil. As semirreações dos eletrodos que constituem as seis células da bateria convencional não selada, são:
Pb(s) + H2SO4(aq) → PbSO4(s) + 2 H + + 2e- e0 = 0,36 Volts
PbO2(s) + H2SO4(aq) + 2e- + 2H+ → PbSO4(s) + 2 H2O(l) e0 = 1,69 Volts
Considerando o enunciado acima, é correto afirmar que
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
Eletroquímica é a parte da química que trata do uso das reações químicas para produzir eletricidade, das capacidades relativas de oxidação e redução e do uso da eletricidade para produzir uma transformação química.
O rompimento de uma adutora de 700 mm de diâmetro na tarde de quinta-feira do dia 22 de março de 2018, localizada no quilômetro 59 da via marginal da Anhanguera, afetou o abastecimento de água em alguns bairros de Jundiaí (SP).
(Adaptado de: https://g1.globo.com)
Esse evento pode ocorrer devido à corrosão eletroquímica. Em tubulações de ferro é adequado fazer proteção catódica, utilizando ânodos fixados na tubulação que fica submersa no solo.
Considere os seguintes potenciais de redução, a 25,0 °C:

O metal mais apropriado como ânodo é o
Sobre a reação a seguir é CORRETO afirmar:
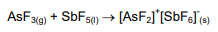
Os potenciais padrões de redução de meia célula são apresentados em uma escala de potencial elétrico em que o zero corresponde ao Zn
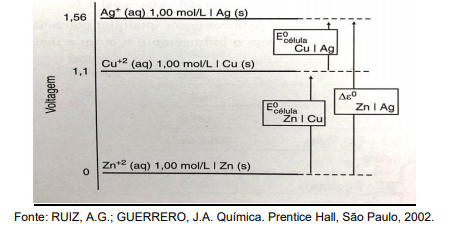
Uma pilha formada por Cu e Ag e outra entre Zn e Cu fornecerão os seguintes potenciais, respectivamente:
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
Em uma célula eletroquímica, ânodo é o eletrodo no qual ocorre a oxidação e cátodo é o eletrodo no qual ocorre a redução.
Considere a pilha de Daniell

Em relação a essa célula eletroquímica, é falso afirmar que:
Um estudante administrou a eletrólise de sulfato de sódio aquoso usando eletrodos inertes e ao final identificou os produtos como hidrogênio
A notação padrão de uma pilha de Daniel composta por zinco e cobre, considerando-se os potencias padrões de redução à 25ºC, E oZn2+= -0,76V e EoCu2+ = +0,34V, será
Considerando-se a reação de oxirredução a seguir, assinalar a alternativa CORRETA
Nas células eletroquímicas, a ponte salina é usada para conectar as semicélulas de oxidação e redução e é constituída por uma solução eletrolítica. A função da ponte salina é de
O eletrodo padrão de hidrogênio (EPH) é considerado como o eletrodo de referência universal. O arranjo físico desse eletrodo consiste na imersão de um fio de platina em uma solução ácida que contém íons H+ na presença de gás hidrogênio borbulhado à pressão constante. No EPH, a função da platina é promover a