Sempre que se liga um aparelho de CD portátil ou um computador portátil, completa-se um circuito que
permite que uma reação química ocorra em uma bateria – uma descendente direta da pilha de Volta de metais e papel. As pilhas e baterias são exemplos de células eletroquímicas.
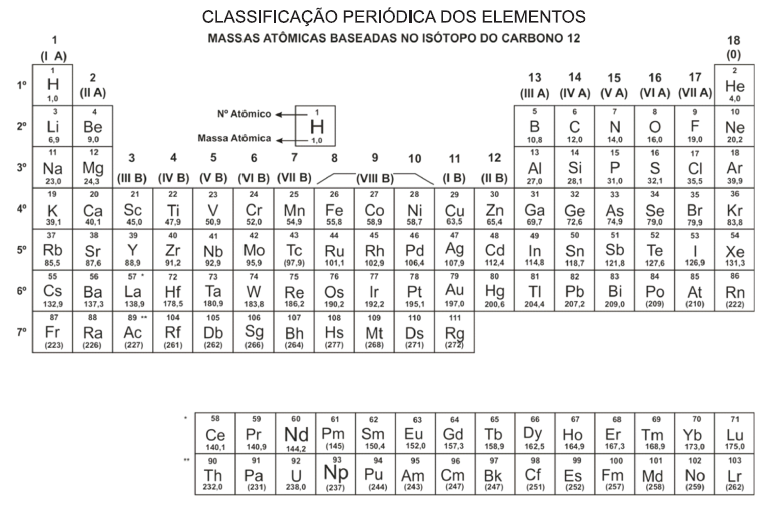
Considere que uma pilha hipotética de dois metais X e Y tem a seguinte representação simbólica: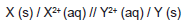 Quantitativamente, os potenciais de redução dos eletrodos foram mensurados em valores de –1,0 V e
Quantitativamente, os potenciais de redução dos eletrodos foram mensurados em valores de –1,0 V e
–3,0 V.
Com base nessas informações, assinale a alternativa em que a característica dessa pilha está incorreta.
Um estudante do IFMS montou uma cela galvânica (pilha) conforme esquema a seguir:
Legenda da figura: (A) placa de estanho, (B) solução aquosa contendo íons Sn2+, (C) placa de alumínio, (D) solução aquosa contendo íons Aℓ3+, (E) fio metálico, (F) resistência elétrica e (G) ponte salina. Considerando os seguintes dados:
E°(Sn2+ +/Sn) = -0,14 V
E°(Aℓ3++/Aℓ) = -1,68 V
Durante o funcionamento da pilha, o estudante fez algumas afirmações:
I. A concentração de íons alumínio aumenta na solução da direita (D).
II. Na placa de alumínio ocorre a corrosão.
III. O fluxo de elétrons ocorre pelo fio metálico a partir da placa de estanho em direção à placa de alumínio. IV. Na placa de estanho ocorre a redução. V. A placa de estanho é o polo negativo da cela galvânica.
Em eletroquímica, definimos potencial de junção como a
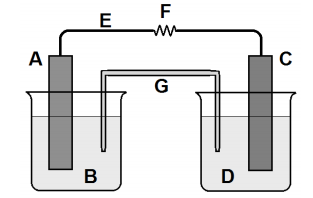
As células de combustíveis ou pilhas de hidrogênio usam gases como combustíveis. Em geral, têm três compartimentos. O primeiro contém hidrogênio (H 2). No segundo compartimento, outro gás que será reagente como o gás oxigênio (O2). Ambos são separados por um terceiro compartimento, um ambiente onde estes gases irão se difundir passando pelos eletrodos e irão reagir, de tal forma que estas células convertem a energia liberada em reações de combustão dos gases em eletricidade. Esse tipo de pilha não se gasta, ou seja, os reagentes são continuamente injetados no aparelho durante o processo de oxirredução.
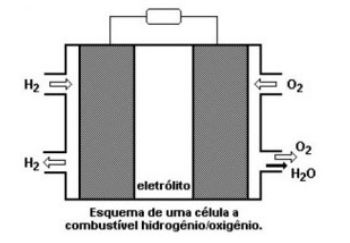
Sobre a pilha de hidrogênio, pode-se afirmar que
É INCORRETO afirmar que
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
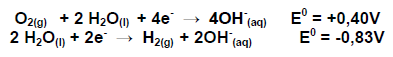
Sobre esta pilha, é correto afirmar que
O processo principal de obtenção do sódio metálico puro e do gás cloro é através da eletrólise de
Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Na queima do magnésio metálico em presença de oxigênio, ocorre a redução do magnésio com o consequente consumo de 1 mol de elétrons por mol de átomos de magnésio.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
Célula eletroquímica é um dispositivo ou sistema que converte energia elétrica em química ou vice‐versa, formado por dois eletrodos em contato com um eletrólito. Em uma pilha galvânica, um conjunto de células eletroquímicas é usado para a produção de eletricidade como resultado de uma reação química espontânea. Em uma célula eletrolítica, a corrente elétrica é usada para produzir uma transformação química.
Um carpinteiro resolveu mexer em sua caixa velha de ferramentas que estava guardada há algum tempo. Ao abri-la, verificou que os pregos estavam enferrujados. O prego é feito de ferro, um metal de fácil oxidação, utilizado na fabricação de várias ferramentas.
Uma das soluções para prevenir a ocorrência desse processo químico é
O alto forno derrete o minério de ferro e o purifica, transformando-o em um líquido contendo 95% de ferro, chamado de ferro-gusa. A reação química que ocorre na transformação do minério de ferro em ferro-gusa é dada por:
Fe2 O3 (l) + 3 CO (g) → 2 Fe (l) + 3 CO2 (g)
PEIXOTO, D. Fabricação do ferro-gusa e do aço.
Disponível em: www.ifba.edu.br. Acesso em: 8 set. 2013.
A formação de ferro-gusa ocorre através de uma reação de
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
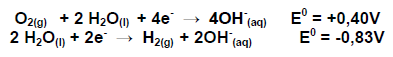
A ordem de grandeza da constante de equilíbrio K da pilha é
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
As reações de oxidação e redução envolvem a transferência de elétrons de uma espécie molecular ou iônica para outra. A redução é a perda de elétrons por uma dada espécie e a oxidação é a fixação desses elétrons por uma determinada espécie.
A massa de cobre metálico, em gramas, que será depositada no cátodo de uma célula eletrolítica contendo solução de CuSO 4, submetida a uma corrente de 2,0 Amperes, durante 10 minutos, considerando rendimento eletrolítico de 100%, é igual a
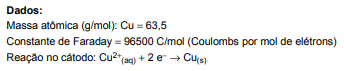
Na figura a seguir, quatro cubas eletrolíticas (I, II, III e IV) contendo soluções aquosas de mesma concentração foram ligadas em série, funcionando sob mesmas condições e durante igual período de tempo.
Sabendo-se que os eletrodos são inertes em todas as cubas, é correto afirmar que em