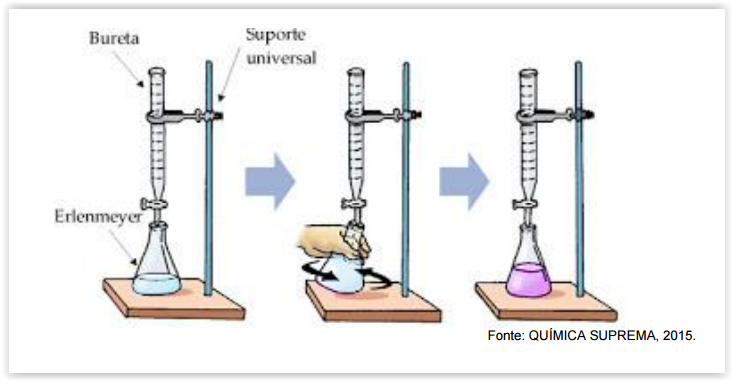
As soluções de hidróxido de sódio são muito utilizadas em diversas análises
via-úmida. Sabendo que o NaOH não é um padrão primário e precisa ser
padronizado, considere a padronização deste composto utilizando biftalato de
potássio e fenolftaleína, como indicado na figura baixo e assinale a alternativa
INCORRETA:
Numa titulação é preciso saber com precisão quando a solução que está sendo padronizada reagiu completamente com o padrão primário. Sobre o ponto final da reação, analise as afirmativas.
I. Ponto de equivalência ou ponto final teórico corresponde ao ponto da titulação em que é adicionada a quantidade de reagente padrão exatamente equivalente à quantidade de analito.
II. É calculado com base na estequiometria da reação envolvida na titulação.
III. Ponto final é o ponto da titulação onde ocorre uma alteração física associada à condição de equivalência. É indicado pela súbita mudança de alguma propriedade física da solução.
IV. A determinação do ponto final pode ser feita pelo uso de indicadores visuais que causam mudança na cor da solução num ponto muito próximo ao ponto de equivalência.
V. A determinação do ponto final pode ser feita, ainda, por métodos instrumentais e respondem a certas propriedades da solução, que mudam de características durante a titulação, tais como: medida de pH, condutividade, potencial, corrente, temperatura, absorbância etc.
Estão corretas as afirmativas
Sabe-se que 10 mL da solução inicial com concentração igual a 2 mol/L foi transferida para um balão volumétrico de 50 mL e o volume foi completado com água destilada. Qual a concentração final da solução de HCL?
Para padronizar uma solução, podem ser utilizados, no comércio, os seguintes padrões primários, EXCETO:
Um analista recebeu uma solução de NaOH 0,5 mol/L (NaOH – MM = 40 g/mol) para ser padronizada. Nesta padronização, foi usado, adequadamente como padrão primário, o ácido oxálico dihidratado (H2C2O4 . 2H2O – MM = 126,07 g/mol) convenientemente preparado. O analista mediu uma massa equivalente a 0,8303 g de ácido oxálico dihidratado e a diluiu em 100 mL de água em um Erlenmeyer, adicionando algumas gotas de fenolftaleína. O analista encheu uma bureta de 50 mL com a solução de NaOH e iniciou a titulação dos 100 mL da solução de ácido oxálico. O ponto de viragem, em que a fenolftaleína tornou‐se violeta, foi alcançado quando o volume NaOH da bureta era de 27,3 mL e a titulação parou. Assinale a alternativa que apresenta o valor da concentração padrão de NaOH.
O rótulo de um frasco de efluente aquoso indica 100 ppm de íons chumbo(II). Sabendo-se que a densidade do efluente é 1,0 g/mL, a concentração de íons chumbo(II) no efluente, em mol/L, é igual a: