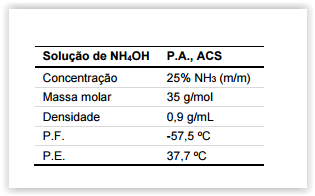
Foi requisitado a um técnico de laboratório que preparasse uma
solução de hidróxido de amônio, a partir de uma solução comercIal
concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
Assinale a alternativa que indica o volume aproximado da solução
comercIal (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
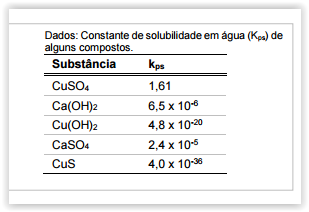
A calda bordalesa, muito utilizada como fungicida na agricultura, é
preparada pela mistura de sulfato de cobre pentaidratado
(CuSO4.5H2O), um pequeno excesso de cal (CaO) e água em
proporção de 1:1:10 (m:m:v), respectivamente, obtendo-se uma
suspensão muito fina (partículas pequenas).
De acordo com os dados de constante de solubilidade, assinale a
alternativa que apresenta o constituinte principal do sólido suspenso
na calda bordalesa.
Uma solução foi preparada pela dissolução de 2,00 g de NaOH (40 g mol-1), com pureza igual a 90%, em água até se obter um volume final de 500 mL. Nesse caso, a concentração da solução, em mol L-1, é igual a
A titulação de uma solução é um procedimento que permite determinar a concentração desconhecida de uma solução. Considere que, na titulação de 80 mL de solução de hidróxido de potássio (KOH), são usados 60 mL de uma solução de ácido clorídrico (HC l) de concentração 0,1 mol/L. A concentração da solução de hidróxido de potássio é
Diversos produtos de limpeza doméstica contêm amônia. Para verificar a concentração de amônia em um dado produto, 5,0 mL foram titulados com HCl 0,1 mol l-1, sendo consumidos 20 mL do ácido para completo consumo da amônia. Qual é a concentração de amônia, em mol l-1, nesse produto?
A figura a seguir representa diluições de uma solução aquosa básica de Ca(OH)2 a partir da solução inicial A.
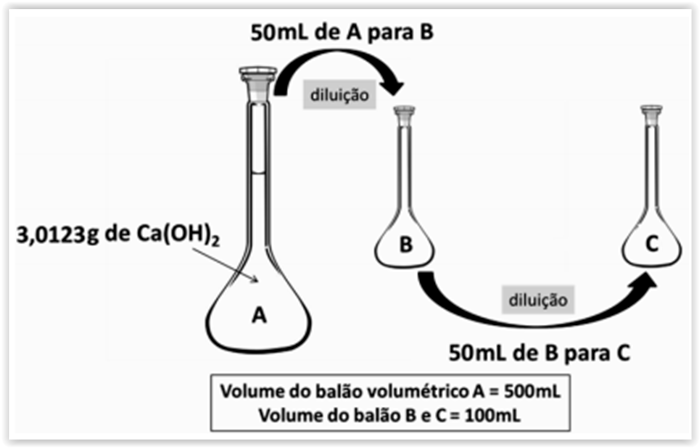
Entende-se que, após o preparo da solução A, coletou-se 50mL do frasco A para o frasco B, completando-o com água
destilada até que o menisco inferior do nível do líquido tangenciasse a linha de aferição do gargalo do balão. Após
homogeneização, coletou-se 50mL de B e passou-se para C, completando C com água destilada até a linha de aferição.
Diante do exposto, assinalar a alternativa CORRETA:
Dados: Ca = 40,078g/mol; O = 15,999g/mol; H = 1,008g/mol.
Artefatos de aço inoxidável são resistentes à corrosão devido a um fenômeno conhecido como passivação, que é a
formação de uma fina camada de óxido de cromo na superfície, por ação do ar ou de oxidantes químicos. Sabendo-se que
o ácido nítrico (HNO3) na concentração de 1,6 mol/L pode ser usado como agente passivante, qual volume de HNO3
concentrado (em litros) deve ser utilizado para a obtenção de 100 L de solução passivante?
(Dados: MM(HNO3) = 63,0 g/mol; HNO3 concentrado: d = 1,40 g/mL; teor máximo = 65%(m/m))
Uma solução de AgNO 3 com concentração de 16,98 g.L-1 (m/v) corresponde em Molaridade (Mol.L-1 ) à concentração de:
Dados: Massa molecular da AgNO 3 =169,8 g.Mol-1
A dureza da água está relacionada à presença de íons metálicos (M 2+) dissolvidos em determinado volume de amostra. Nesse contexto, para determinar a dureza da água, um volume de 50 mL foi titulado com uma solução 0,01 mol L-1 de EDTA, gastando-se um volume médio de 7 mL dessa solução. A equação química geral representativa do processo está descrita a seguir.
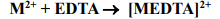
A dureza da água, expressa em mg de CaCO3 por litro de amostra, é igual a
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Em uma titulação ácido-base, um ácido é titulado com outro ácido com o objetivo de determinar a sua concentração. Nesse caso, o titulante é uma solução de concentração conhecida adicionada por meio de uma bureta.
A água, por suas propriedades físicas e químicas, é considerada como o "solvente universal", que pode dissolver um grande número de substâncias. Com os dados das solubilidades de uma substância na água, à pressão constante e a uma determinada temperatura, é possível construir gráficos denominados de curva de solubilidade. O gráfico a seguir representa a solubilidade do CO2.
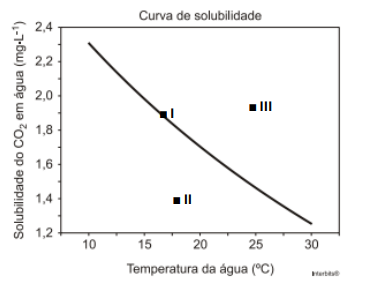
Nesse gráfico, constata-se que
Um técnico de laboratório de ciências precisa de um recipiente com escala entre 50 e 100 mililitros, usada para misturar e dissolver substâncias, e de uma vidraria para armazenar, preparar, aquecer ou recolher soluções. As vidrarias a serem usadas para esses propósitos são, respectivamente,
Em um laboratório de ciências, a limpeza do material de vidro é fundamental para garantir o bom desenvolvimento das atividades experimentais. Durante uma atividade prática, foram realizados alguns procedimentos relacionados com a limpeza da vidraria, detalhados a seguir:

Os procedimentos que revelam práticas INADEQUADAS no laboratório de ciências estão presentes nos itens
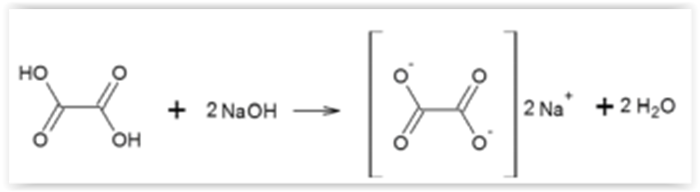
Considerando-se a reação de padronização do
hidróxido de sódio com ácido oxálico na presença de
fenolftaleína, assinalar a alternativa CORRETA:
Sobre as características das soluções, assinalar a alternativa CORRETA: