Uma solução Um Normal contém um(a)
Assinale a molalidade de uma solução preparada pela dissolução de 5,0g de glicose (C6H12O6) em 50mL de água destilada.
Na diluição de soluções, a fórmula “C1.V1 = C2.V2" (C1 = Concentração Inicial; C2 = Concentração Final; V1 = Volume Inicial, V2 = Volume Final) só é verdadeira quando o(a)
A titulação potenciométrica tem as seguintes características importantes:
Nos municípios onde foi detectada a resistência do Aedes aegypti, o larvicida tradicional será substituído por outro com concentração de 10% (v/v) de um novo princípio ativo. A vantagem desse segundo larvicida é que uma pequena quantidade da emulsão apresenta alta capacidade de atuação, o que permitirá a condução de baixo volume de larvicida pelo agente de combate às endemias. Para evitar erros de manipulação, esse novo larvicida será fornecido em frascos plásticos e, para uso
em campo, todo o seu conteúdo deve ser diluído em água até o volume final de um litro. O objetivo é obter uma concentração final de 2% em volume do princípio ativo.
Que volume de larvicida deve conter o frasco plástico?
A acidez de uma solução é definida pela concentração de íons H+. Considerando-se essa afirmação, assinale a alternativa que corresponde a uma substância capaz de transformar uma solução ácida em uma solução básica.
Uma unidade de concentração é composta por uma unidade de
O vinagre é um produto alimentício resultante da fermentação do vinho que, de acordo com a legislação nacional, deve apresentar um teor mínimo de ácido acético (Ch3COOH) de 4% (v/v). Uma empresa está desenvolvendo um kit para que a inspeção sanitária seja capaz de determinar se alíquotas de 1 mL de amostras de vinagre estão de acordo com a legislação.
Esse kit é composto por uma ampola que contém uma solução aquosa de Ca(OH)2 0,1 ![]() e um indicador que faz com que a solução fique cor-de-rosa, se estiver básica, e incolor, se estiver neutra ou ácida. Considere a densidade do ácido acético igual a
e um indicador que faz com que a solução fique cor-de-rosa, se estiver básica, e incolor, se estiver neutra ou ácida. Considere a densidade do ácido acético igual a ![]() a massa molar do ácido acético igual a
a massa molar do ácido acético igual a ![]() e a massa molar do hidróxido de cálcio igual a
e a massa molar do hidróxido de cálcio igual a ![]()
Qual é o valor mais próximo para o volume de solução de Ca(Oh)2, em ml, que deve estar contido em cada ampola do kit para garantir a determinação da regularidade da amostra testada?
Os métodos gravimétricos são quantitativos e se baseiam na determinação da(o)
Uma substância pura, solúvel em água, tem massa molar igual a 42,5 g mol-1 e, na temperatura de 25ºC, essa substância está no estado líquido, cuja massa específica é igual a 0,85 kg L-1. Uma solução foi preparada diluindo 200 cm3 desse líquido, em água, até completar o volume de dois litros de solução. A concentração da solução obtida, em mol L-1, é
Para determinar a concentração de uma solução de hidróxido de cálcio, Ca(OH)
2, 5,00 mL dessa solução foram titulados até atingir o ponto estequiométrico com 23,5 mL de ácido clorídrico (HC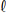
Um estudante misturou 50 mL de solução aquosa de ácido sulfúrico 0,10 mol/L com 50 mL de solução aquosa de hidróxido de sódio 0,40 mol/L e introduziu algumas gotas de fenolftaleina. O processo pode ser representado pela equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(aq) + H2O(l)
Ao término da reação, pode-se concluir acertadamente que
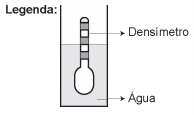
Usando um densímetro cuja menor divisão da escala, isto é, a diferença entre duas marcações consecutivas, é de 5,0 x 10 -2 g cm-3, um estudante realizou um teste de densidade: colocou este instrumento na água pura e observou que ele atingiu o repouso na posição mostrada.
Em dois outros recipientes A e B contendo 2 litros de água pura, em cada um, ele adicionou 100 g e 200 g de NaCl, respectivamente.
Quando o cloreto de sódio é adicionado à água pura ocorre sua dissociação formando os íons Na+ e Cl-. Considere que esses íons ocupam os espaços intermoleculares na solução.
Nestes recipientes, a posição de equilíbrio do densímetro está representada em:
Em um estudo recentemente publicado, elevadas concentrações de metais foram encontradas nas águas do Rio Doce, após o rompimento da barragem do Fundão. Níquel, cobre e alumínio foram encontrados nessas amostras, respectivamente, em concentrações aproximadamente 43, 86 e 47 vezes maiores que os valores máximos permitidos (VMP), de acordo com a legislação brasileira. Considerando os limites descritos na tabela a seguir, assinale a alternativa que representa a concentração desses metais, em ppm, encontrada nas amostras analisadas.

O cálcio apresenta elevada abundância em solos e águas naturais, e diversas metodologias analíticas podem ser empregadas para a sua adequada quantificação. Desde a década de 50 até os dias atuais, o método titrimétrico de complexação do cálcio com EDTA, em meio alcalino, tem sido empregado com êxito para essa finalidade. Acerca das titulações de complexação com o EDTA, assinale a alternativa correta.