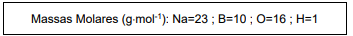Uma solução é preparada dissolvendo 4,8 kg de um composto de massa molar desconhecida em 120 g de água e tem o ponto de congelação de –1,50 °C. Considerando a constante crioscópica da água igual a 1,86 °C kg H2O/mol do soluto, a massa molecular do composto formado é
Ainda com relação aos indicadores de padrão nacional de qualidade do ar, considere que em uma amostra de 1000 cm3 de ar atmosférico foram encontrados 5 nmols de dióxido de nitrogênio (NO2). Sabendo que o Conselho Nacional de Meio Ambiente (Conama) considera 320 µg.m3 níveis máximos aceitáveis (padrão primário) e 190 µg.m3 níveis desejáveis (padrão secundário) (Resolução CONAMA nº 03, de 28/06/90), assinale a alternativa que apresenta a concentração de NO2 e sua relação com os padrões de qualidade do ar estabelecidos.
(Dados: massa atômica N=14, O=16)
Uma caixa vazia com capacidade de 10 L de volume encontra-se em um ambiente cuja pressão é 1 atm e a temperatura 25ºC.

Um técnico injeta 1 mol de H2(g) e, logo em seguida (sem retirar esse gás), injeta mais 1 mol de He(g). Em relação ao volume em litros do H2(g), do He(g) e da mistura gasosa dentro da caixa, é CORRETO afirmar:
A fermentação da glicose (C 6H12O6) produz etanol (C2H6O) e dióxido de carbono (CO2), conforme a equação química não balanceada abaixo:

(Massas molares (g mol
-1): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
O número de mols presentes em 21,6 gramas de prata é o mesmo que o número de mols contidos em
Um estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq).
Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
Uma mistura que consiste de 12,0 g de Sb 2S3, K2S e Bi2S3 reage completamente com oxigênio molecular, formando-se óxido de antimônio (III), óxido de potássio e óxido de bismuto (III). Sobre esse processo, assinale as afirmações abaixo com V (verdadeiro) ou F (falso).
( ) A massa de óxidos obtida é maior do que 12 g.
( ) Ocorre oxidação dos cátions causada pelo oxigênio molecular.
( ) Ocorre redução do oxigênio molecular.
( ) Formam-se 4 g de cada óxido.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
A fórmula mínima determinada para um composto orgânico foi CH2O. Em um estudo subsequente, determinou-se que a sua massa molar era 180 g . mol-1.
A fórmula molecular do composto é
Qual é a massa, em gramas, de NaCl necessária para precipitar todos os íons prata presentes em 15,0 mL de solução de 0,125 mol L -1 de AgNO3?
(Massas molares (g mol-1): Na = 23; Cl = 35,5; Ag = 108; N = 14; O = 16)
O gás dióxido de enxofre (SO 2) é um dos principais e mais perigosos poluentes ambientais. No Brasil, é usado pelo Conselho Nacional de Meio Ambiente (Conama) como um importante indicador do padrão nacional de qualidade do ar (Resolução CONAMA nº 03, de 28/06/90). Para a adequada interpretação dos dados analíticos na determinação das concentrações de SO2 no ar atmosférico, frequentemente é necessária a conversão de quantidade de matéria presente no ar atmosférico em quantidade de mols. Assim, assinale a alternativa que indica, para uma amostra de ar atmosférico contendo 8g de SO2, aproximadamente, a quantidade de moléculas de SO2 presentes, assim como o número de mols de SO2, respectivamente.
(Dados: número de Avogadro=6,02x1023 ; massa atômica O=16, S=32)
A massa de hidróxido de sódio necessária à preparação de 500 mL de uma solução 0,2 mol/L, é:
Adotar nessa questão, massas atômicas: H = 1, O = 16, Na = 23.
A oxigenoterapia consiste na administração suplementar de oxigênio (O2) gasoso a um paciente, com o objetivo de elevar ou manter a saturação de oxigênio aos níveis aceitáveis, corrigindo uma possível deficiência no aporte de oxigênio aos tecidos nesse indivíduo. A quantidade de oxigênio a ser administrada é medida em função do teor de oxigênio no paciente, e as informações sobre a quantidade de mols de O2 são necessárias para a correta aplicação da técnica. A esse respeito, assinale a alternativa que apresenta aproximadamente o número de mols de oxigênio em uma amostra contendo 1,20x1021 moléculas de O2.
(Dados: número de Avogadro=6,02x1023)
Questão anterior:

Ainda a respeito da produção de amônia, conforme reação apresentada anteriormente (questão 52), assinale a alternativa que apresenta, respectivamente, quantas moléculas de H2(g) serão consumidas na reação, considerando que foram consumidas 3,60x1020 moléculas de N2(g), e quantos mols de NH3(g) serão produzidos, se forem empregados 1,2mols de N2.
Uma amostra de sulfato cúprico hidratado pesando 125,2 g foi seca em estufa a 110°C para remover toda a água de hidratação. Após a secagem, a amostra pesou 80,0 g. Então a fórmula do sal hidratado em questão é
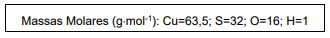
Trifluoreto de boro reage com boridreto de sódio e produz tetrafluorborato de sódio e diborano, que, ao reagir com o oxigênio do ar, produz óxido de boro e água, como representado nas equações químicas não balanceadas:
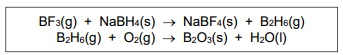
Partindo-se de 111 gramas de boridreto de sódio e considerando que este é o reagente limitante e, ainda, que o rendimento da reação é 90%, a massa, em gramas, de óxido de boro produzido será