A água consumida na maioria das cidades brasileiras é obtida pelo tratamento da água de mananciais. A parte inicial do tratamento consiste no peneiramento e sedimentação de partículas maiores. Na etapa seguinte, dissolvem-se na água carbonato de sódio e, em seguida, sulfato de alumínio. O resultado é a precipitação de hidróxido de alumínio, que é pouco solúvel em água, o qual leva consigo as partículas poluentes menores. Posteriormente, a água passa por um processo de desinfecção e, finalmente, é disponibilizada para o consumo.
No processo descrito, a precipitação de hidróxido de alumínio é viabilizada porque
Hipoxia ou mal das alturas consiste na diminuição de
oxigênio (O2) no sangue arterial do organismo. Por essa
razão, muitos atletas apresentam mal-estar (dores de
cabeça, tontura, falta de ar etc.) ao praticarem atividade
física em altitudes elevadas. Nessas condições, ocorrerá
uma diminuição na concentração de hemoglobina
oxigenada (HbO2) em equilíbrio no sangue, conforme a
relação:
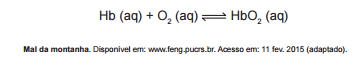
A alteração da concentração de hemoglobina oxigenada
no sangue ocorre por causa do(a)
Vários ácidos são utilizados em indústrias que
descartam seus efluentes nos corpos d'água, como
rios e lagos, podendo afetar o equilíbrio ambiental.
Para neutralizar a acidez, o sal carbonato de
cálcio pode ser adicionado ao efluente, em
quantidades apropriadas, pois produz bicarbonato,
que neutraliza a água. As equações envolvidas no
processo são apresentadas:
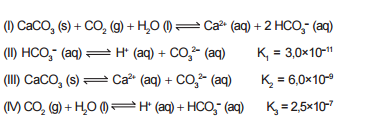
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25°C,qual é o valor numérico da constante de equilíbrio da reação I ?
Um analista recebeu uma solução de NaOH 0,5 mol/L (NaOH – MM = 40 g/mol) para ser padronizada. Nesta padronização, foi usado, adequadamente como padrão primário, o ácido oxálico dihidratado (H2C2O4 . 2H2O – MM = 126,07 g/mol) convenientemente preparado. O analista mediu uma massa equivalente a 0,8303 g de ácido oxálico dihidratado e a diluiu em 100 mL de água em um Erlenmeyer, adicionando algumas gotas de fenolftaleína. O analista encheu uma bureta de 50 mL com a solução de NaOH e iniciou a titulação dos 100 mL da solução de ácido oxálico. O ponto de viragem, em que a fenolftaleína tornou‐se violeta, foi alcançado quando o volume NaOH da bureta era de 27,3 mL e a titulação parou. Assinale a alternativa que apresenta o valor da concentração padrão de NaOH.
A produção de hidrogênio para uso industrial, que tem como um
dos principais mercados a produção de amônia, intermediário de
fertilizantes, é bem conhecida e feita por processo de reforma de
gás natural, rico em metano, representado pelo equilíbrio:
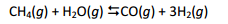
Em um balão fechado sob temperatura constante essa reação
tem uma constante de equilíbrio (Kc) igual a 4,00
A análise desse sistema gasoso em equilíbrio determinou a
concentração de metano = 0,100 mol.L–1, de água = 0,005 mol.L–1
e de monóxido de carbono = 0,250 mol.L–1
Nessas condições, a concentração de gás hidrogênio nesse
equilíbrio, em mol.L–1, é de
Os óxidos de nitrogênio são os componentes principais das
névoas, um fenômeno ao qual os habitantes das grandes cidades
estão habituados. O óxido nítrico forma‐se em pequenas
quantidades nos cilindros de combustão interna dos motores
pela combinação direta de nitrogênio e oxigênio:
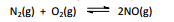
A constante de equilíbrio para essa reação aumenta de
aproximadamente 10–15 a 300K para cerca de 0,05 a 2400 K
(temperatura aproximada no cilindro de um motor em
funcionamento).
Com relação à reação entre o gás nitrogênio e o gás oxigênio,
assinale a afirmativa correta.
Uma das etapas do tratamento da água é a desinfecção, sendo a cloração o método mais empregado. Esse método consiste na dissolução do gás cloro numa solução sob pressão e sua aplicação na água a ser desinfetada. As equações das reações químicas envolvidas são:
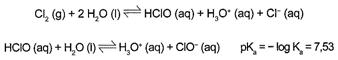
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de:
Em um recipiente de volume constante foi efetuada a reação de
decomposição:
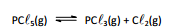
Inicialmente a pressão parcial do pentacloreto de fósforo era de
2,0 bar. A atingir o equilíbrio foi constatada uma porcentagem de
decomposição de 98%.
Se esse sistema em equilíbrio for perturbado pela adição de
0,01 mol de gás cloro, mantendo-se constante as condições
anteriores, quando o novo equilíbrio for atingido
A sílica gel utilizada nos dessecadores apresenta coloração azul na forma anidra e rosa na presença de umidade. Este fenômeno pode ser representado na equação a seguir.
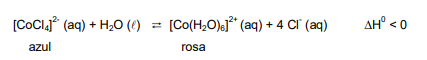
A cor azul pode ser observada quando o sistema em equilíbrio é:
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
A eventual dissolução de nitrato de amônio em água causaria a diminuição do pH da água.
Uma amostra de 10,0 g de carbono foi colocada em um
reator de 1,00 L, na presença de 0,050 mol de CO2, sendo,
a seguir, aquecida a uma temperatura T. Quando a
reação alcança o equilíbrio, tem-se 0,044 mol de CO.
Considerando-se esse resultado e as condições do experimento,
qual é o valor que mais se aproxima do valor da
constante de equilíbrio (Kc) para a reação de formação
de CO a partir do C e do CO2?
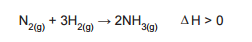
A produção industrial de amônia se dá pela reação dos
gases hidrogênio e oxigênio.
Com base em conhecimentos de cinética química e de
equilíbrio químico, é possível melhorar o rendimento
da reação acima em um reator de diferentes maneiras,
EXCETO


