A existência de Periodicidade de Propriedades dos Elementos Químicos se deve às características de distribuição eletrônica de cada elemento em seu “estado fundamental” de energia. Sobre as Propriedades periódicas dos elementos, é correto afirmar que
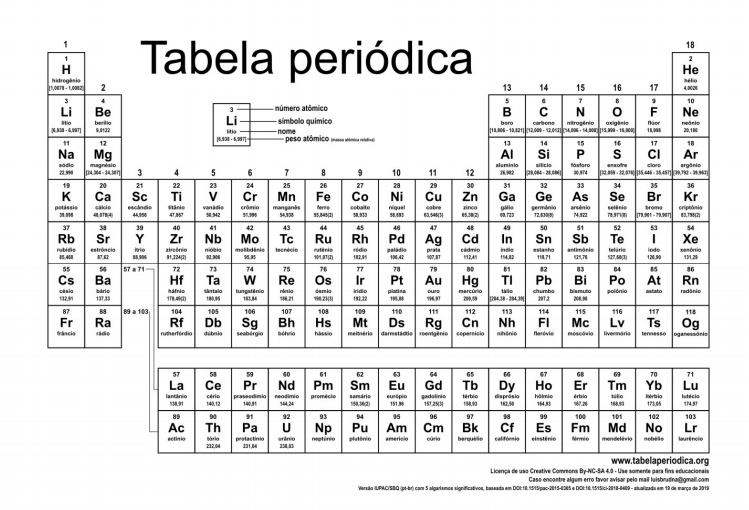
O pleno entendimento das propriedades periódicas implica saber que a Tabela Periódica é composta por grupos ou famílias (colunas) e períodos ou camadas eletrônicas (linhas), de maneira que todos os elementos de um mesmo grupo possuem o mesmo número de elétrons na última camada enquanto que, em um mesmo período, todos os elementos possuem o mesmo número de camadas eletrônicas. A figura a seguir apresenta a Tabela Periódica de elementos químicos. Baseado na observação da Tabela e no estudo das propriedades periódicas dos elementos, pode-se afirmar que
Os átomos ligam-se uns aos outros de diversas maneiras para "montar" todas as coisas que estão à nossa volta. O estudo da maneira em que os átomos se ligam, ou seja, das ligações químicas, é de fundamental importância para se entender as propriedades da matéria e como ela se comporta. Há dois modos principais pelos quais as ligações químicas podem ser formadas: em um deles, a ligação iônica, as partes envolvidas ("blocos construtores") encontram-se na forma de íons (possuem carga elétrica, decorrente do ganho ou perda de elétrons). Por exemplo, NaCl- sal de cozinha. Na ligação covalente, há o compartilhamento de elétrons entre dois átomos neutros. Por exemplo é o diamante, formado apenas por átomos de carbono ligados covalentemente.
Fonte:http://web.ccead.puc-rio.br/condigital/mvsl/Sala%2...
Sobre as propriedades gerais associadas a compostos iônicos e covalentes, pode-se afirmar que
Existe atualmente muita preocupação de que os aumentos antropogênicos nos gases do efeito estufa possam induzir o rápido aquecimento da superfície da Terra. Existem gases causadores do efeito estufa que ocorrem naturalmente e mostram grandes aumentos ao longo do século passado devido à atividade humana. Sobre o tema, analise as afirmativas a seguir.
I. O principal gás responsável pela geração do efeito estufa é o vapor de água troposférico. Sua concentração atmosférica provém unicamente de fontes naturais, tais como evapotranspiração e atividade vulcânica.
II. Os principais gases antrópicos são o CO2, o CH4 e o N2O.
III. Modelos matemáticos climáticos projetam que as temperaturas globais de superfície provavelmente aumentarão no intervalo entre 1,1 e 6,4°C, e o nível médio das águas do mar será consequência deste fenômeno e estará associado à redução do nível do mar, fato que trará impactos ambientais e socioeconômicos significativos para as comunidades locais.
Assinale
Sobre a cinética enzimática, é correto afirmar que
O conhecimento da velocidade das reações químicas é de extrema importância para a produção industrial de uma série de produtos. Sobre o tem, assinale a alternativa correta.
Pode-se dividir o tratamento de água em duas etapas: tratamento inicial e final. No tratamento inicial não há reações químicas envolvidas, somente processos físicos (peneiramento, sedimentação ou decantação e aeração). No tratamento final, há reações químicas envolvidas na coagulação ou floculação, seguidas de processos físicos de sedimentação e filtração, além de desinfecção (processo químico). Assinale a alternativa que melhor representa a essência dos reagentes utilizados de coagulação.
Uma possibilidade de conversão gás-partícula é a reação direta entre gases resultando em finas partículas sólidas dispersas no ar. Um exemplo é a reação de neutralização de amônia com cloreto de hidrogênio em fase gasosa, que resulta em finas partículas de cloreto de amônio dispersas no ar, formando uma névoa. Essa reação é apresentada em um experimento clássico que ilustra a velocidade de difusão de gases e sua dependência com a massa molar. A reação de formação de NH4Cl (anel branco) ocorre na parte do tubo mais próxima à extremidade onde o HCl é introduzido. Dados: peso molar: H = 1 g/mol, N = 14 g/mol; Cl = 35,5 g/mol. Fonte: http://www.scielo.br/scielo.php?script=sci_arttext... 40422017000700824.

Assim, sendo a velocidade de difusão do cloreto de amônio igual a 27 km/min, pode-se determinar que a velocidade de difusão do HCl no sistema de Graham mostrado acima é
baixo tem-se a estrutura de argilomineral do tipo esmectita. A vermiculita é um argilomineral que se enquadra neste grupo.
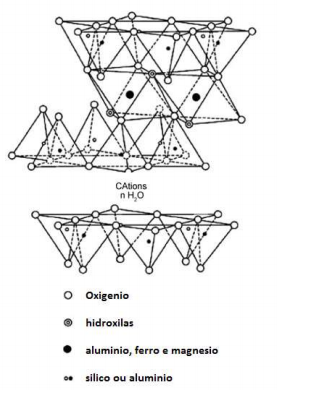
Sua formula química é dada por:
MX , (Si +45,7 Al+32,3) (Al+30,5 Mg +24,8 Fe+30,7) O20 (OH)4
Sendo Mx a representação da carga da camada do composto mineral supracitado. A massa molecular da vermiculita é aproximadamente
Em um recipiente de 104 mL foram colocados 0,020 mmol de pentacloreto de fósforo submetido a uma temperatura elevada, e então este composto converteu-se ao cloreto de fósforo trivalente após a decomposição térmica. O sistema em questão é reversível e tende ao equilíbrio químico. Atingida esta condição, verificou-se que a concentração do gás formado foi de 0,7 mol/L. Assim sendo, a constante de equilíbrio calculada para este processo será, aproximadamente
As células de combustíveis ou pilhas de hidrogênio usam gases como combustíveis. Em geral, têm três compartimentos. O primeiro contém hidrogênio (H 2). No segundo compartimento, outro gás que será reagente como o gás oxigênio (O2). Ambos são separados por um terceiro compartimento, um ambiente onde estes gases irão se difundir passando pelos eletrodos e irão reagir, de tal forma que estas células convertem a energia liberada em reações de combustão dos gases em eletricidade. Esse tipo de pilha não se gasta, ou seja, os reagentes são continuamente injetados no aparelho durante o processo de oxirredução.
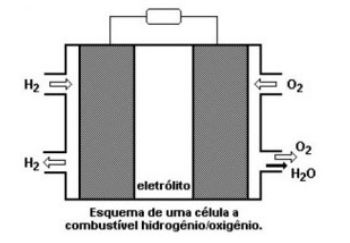
Sobre a pilha de hidrogênio, pode-se afirmar que
A respeito dos conceitos de equilíbrio químico, entalpia, entropia e energia livre, assinale a alternativa correta.
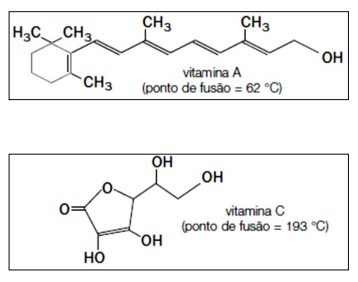
Observe a imagem das estruturas a seguir e assinale a alternativa correta.
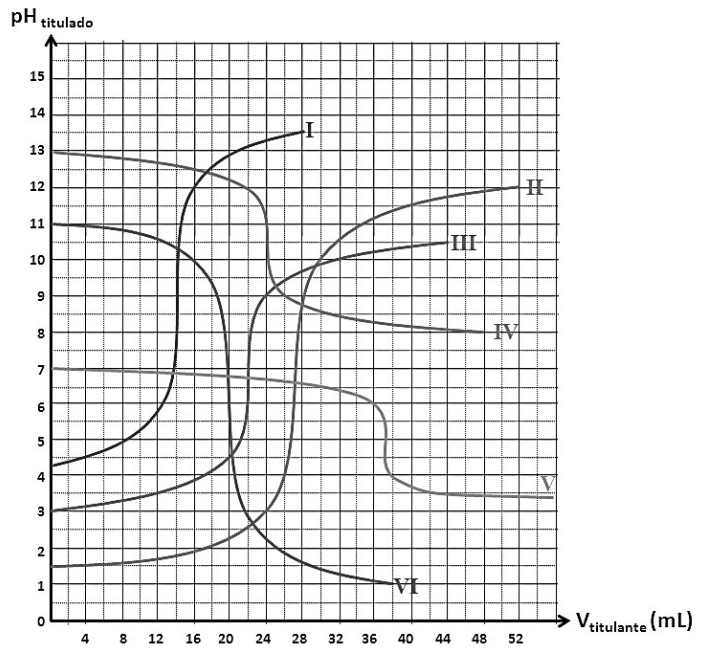
Analise a figura a seguir e assinale a alternativa que apresenta a numeração do gráfico cuja curva de titulação poderia representar uma reação de neutralização de uma base forte com um ácido fraco.