Uma amostra de mármore foi mergulhada em uma solução de ácido muriático e, após alguns segundos, observou-se a formação de um gás. Na tentativa de conhecer a identidade desse gás, um experimentador borbulhou-o em uma solução A e observou a formação de um precipitado. As identidades do gás, liberado na reação descrita, e da solução A, responsável pela formação do precipitado, são, respectivamente:
O ambiente do laboratório exige conhecimento sobre regras de segurança fundamentais para prevenções de acidentes. Considere as seguintes afirmações sobre regras de segurança.
I. O armazenamento de substâncias em capelas deve ser feito respeitando as regras de compatibilidade entre reagentes.
II. São considerados EPIs utilizados em laboratórios de ensino: óculos de segurança, máscara de proteção respiratória com filtro adequado, luvas e aventais de algodão.
III. As soluções preparadas em laboratório devem ser rotuladas contendo no mínimo as seguintes informações: nome da solução, fórmula química da substância, concentração, data de preparação e nome do responsável pela preparação.
IV. O transporte de frascos grandes contendo produtos químicos deve ser feito com o uso de carrinhos de transporte. No caso de frascos de dimensões intermediárias deve-se segurá-los com cuidado e, de preferência, apoiando-os junto ao corpo.
Estão corretas somente as afirmações:
A organização de um almoxarifado de produtos químicos requer o conhecimento das principais propriedades dos materiais, principalmente com relação às incompatibilidades entre diferentes substâncias. Assinale a alternativa em que ambas as substâncias devem ser mantidas fora do contato com o ácido sulfúrico, devido a forte reação possível de acontecer.
Analise a estrutura de uma substância representada a seguir:
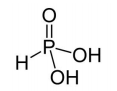
Assinale a alternativa que possui dados corretos referentes à substância citada.
Um técnico de laboratório preparou 1,0 L de solução aquosa de ácido clorídrico 1,2 mol/L para ser utilizada em uma aula prática de química. A solução foi preparada a partir da diluição de uma solução de ácido clorídrico concentrado. No rótulo do frasco de ácido concentrado utilizado constavam as seguintes informações: densidade 1,18 g/mL e teor de 37% em massa de HCl. O volume de ácido clorídrico concentrado, em mL, utilizado pelo técnico na preparação da solução diluída de HCl, foi igual a:
Certa solução aquosa a 25°C apresenta [OH-] = 10 -10 mol/L. Essa solução apresenta pH:
Um recipiente tem as dimensões 2,5 m x 50 cm x 60 mm. Se esse recipiente for preenchido com água a 0oC, qual a quantidade de calorias são necessárias para aquecer esse volume de água a 100oC?
Dados: Ccalorífica H2O: 1Cal °C -1 g-1; densidade H2O = 1 g mL-1
A técnica de espectrofotometria de absorção no UV-VIS utiliza-se de um método para determinar, de modo quantitativo, a concentração de substâncias em solução que absorvem radiação. A Lei de Lambert-Beer (A = b.C.ε) possui aplicações nesta determinação. Sobre esta lei, é correto afirmar que:
A seguinte equação representa uma reação química utilizada em uma determinação de íons brometo em solução:
AgNO 3(aq) + Br - (aq) → AgBr(s) + NO3-(aq)
Em uma análise gravimétrica utilizou-se 50 mL de uma amostra de um efluente. Como resultado da análise foram obtidos 187,8 mg de brometo de prata. Com base na equação apresentada, qual a concentração de íons brometo na amostra analisada?
O equipamento representado na Figura 1 pode ser utilizado para coletar o gás produzido na reação de zinco (frasco A) com solução de ácido clorídrico (frasco B).
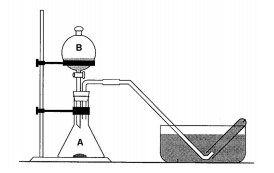
O gás produzido na reação e o nome do instrumento B são, respectivamente:
A sílica gel utilizada nos dessecadores apresenta coloração azul na forma anidra e rosa na presença de umidade. Este fenômeno pode ser representado na equação a seguir.
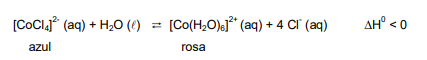
A cor azul pode ser observada quando o sistema em equilíbrio é:
Busca-se construir uma pilha que apresente diferença de potencial teórica em torno de ΔE = +2,5V. Considere a tabela de potenciais de redução, apresentada a seguir.
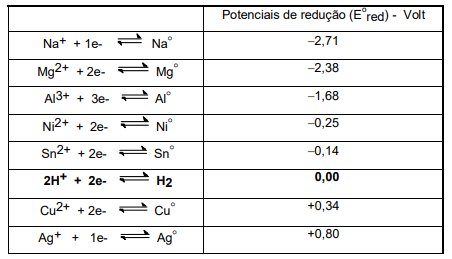
Indique a alternativa que descreve a reação química adequada para produzir a referida pilha.
Para verificar a qualidade de uma matéria-prima, um químico orgânico analista fez um ensaio utilizando a técnica de cromatografia em camada delgada. A coleta do material foi realizada, seguindo critérios de amostragem, a partir de dois lotes. A análise foi realizada utilizando uma substância padrão (P), segundo recomendações da Farmacopéia Brasileira. Os resultados encontrados estão representados no cromatograma (Figura 1), onde P = padrão; A1 = amostra do lote 1 e A2 = amostra do lote 2.
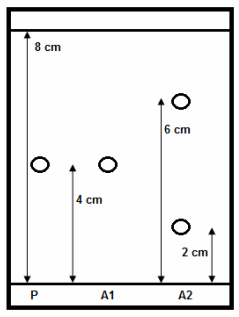
A partir da análise do cromatograma, assinale a alternativa correta.
A soma dos coeficientes estequiométricos da equação química balanceada da reação de neutralização completa do ácido fosfórico com hidróxido de cálcio, com formação de fosfato de cálcio e água é igual a:
Na preparação de 1 litro de uma solução foram dissolvidos em água destilada 117 mg de NaCl e 111 mg de CaCl2. A quantidade em mol de íons cloreto presente nessa solução é:

