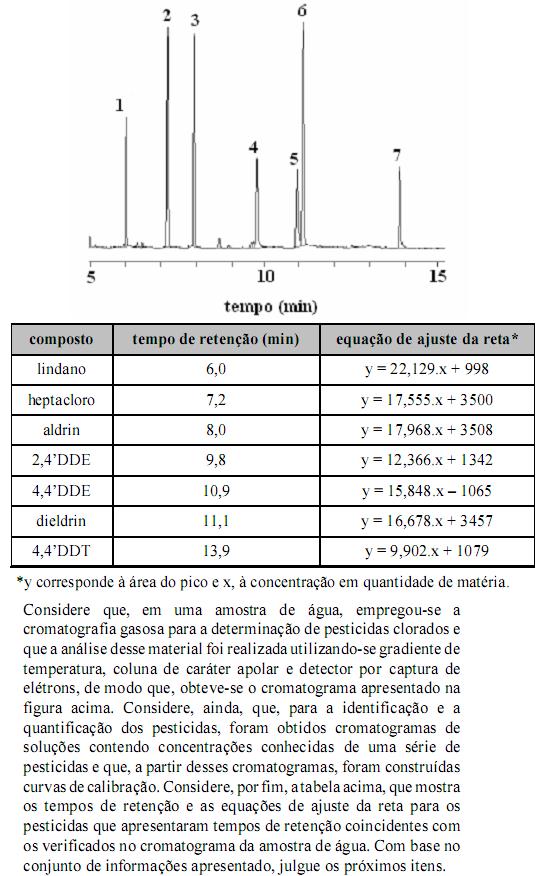
Considerando-se a fase estacionária da coluna utilizada, é correto afirmar que o composto correspondente ao pico 7 apresenta maior ponto de ebulição que o composto correspondente ao pico 1.
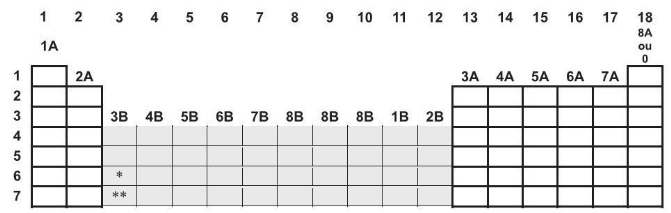
Analisando o esboço da tabela periódica e a posição de cada elemento nos espaços em branco e sabendo que há uma relação entre a posição do elemento e a distribuição dos seus elétrons em subníveis e níveis na camada de valência, está INCORRETO afirmar que os átomos dos elementos situados no
A compreensão do espectro de emissão do hidrogênio foi um marco importante no entendimento da natureza da matéria. A série de Balmer é um conjunto de linhas atômicas do espectro do hidrogênio que abrange a região do visível. A linha de maior energia da série ocorre em 389 nm, e a de menor energia ocorre em 656 nm, quando medidas no vácuo (velocidade da luz igual a 3 x 108 m/s).
A diferença de frequência (em Hz ou s-1 ) entre essas duas transições espectrais é
A lei de Beer relaciona a absorvância de uma substância com a sua concentração, o que permite o uso da fotometria de absorção em análise quantitativa. A lei de Beer
Em solução aquosa, há reações em que a união de íons positivos a íons negativos conduzem à formação de substâncias muito pouco solúveis. Isso acontece, por exemplo, quando solução aquosa de nitrato de chumbo II entra em contato com solução aquosa de cromato de potássio. Íons chumbo se unem instantaneamente a íons cromato formando cromato de chumbo II com valor de 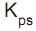 = 1,8 x 10-14 .
= 1,8 x 10-14 .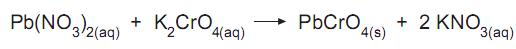
Se a uma solução aquosa contendo 0,01 mol de nitrato de chumbo II adiciona-se um volume pequeno de solução aquosa contendo 0,00002 mol de cromato de potássio, a quantidade máxima de precipitado de cromato de chumbo II que se forma é, em miligramas, aproximadamente igual a
Os resultados de medição de Hg em quatro alíquotas de uma amostra de solo coletada numa região específica de um garimpo foram: 44,0; 54,0; 52,0; 50,0 e 48,0 mg/kg, com desvio padrão do conjunto igual a 3,8 mg/kg.
Considerando a distribuição t-student (cujo valor de parâmetro t é igual a 2,8 para graus de liberdade igual a 4 e 95% de limite de confiança) a concentração de Hg, em mg/kg, está compreendida entre
Várias fases sólidas são usadas para obter-se separação entre espécies químicas tirando vantagem de pequenas diferenças em alguma propriedade de duas ou mais espécies químicas. Dentre essas propriedades, NÃO se inclui
Um balão contém em seu interior 2,0 L de gás He na temperatura de 25 °C. Esse balão foi introduzido em um recipiente com nitrogênio líquido para reduzir a temperatura do gás para -193 °C (80 K), mantendo a pressão inalterada.
Considerando o comportamento ideal do gás, o volume do balão será reduzido a aproximadamente
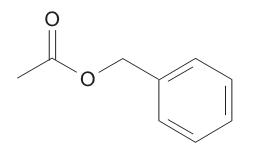
Os ésteres são substâncias amplamente encontradas na natureza, geralmente responsáveis pelo aroma agradável das frutas. O éster visto acima possui um delicioso cheiro de jasmim.
A nomenclatura dessa substância é
As reações químicas envolvem substâncias reagentes e substâncias produtos, conforme as reações abaixo.
Reação 1: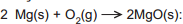 reação que acontece em flashes descartáveis de fotografia.
reação que acontece em flashes descartáveis de fotografia.Reação 2:
 reação advinda do acionamento de dispositivos de segurança presentes nos auto
móveis, chamados
airbags. A decomposição do NaN3(s)
origina N
2(g), que os faz inflar.
reação advinda do acionamento de dispositivos de segurança presentes nos auto
móveis, chamados
airbags. A decomposição do NaN3(s)
origina N
2(g), que os faz inflar. Reação 3:
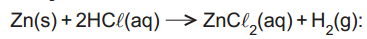 : reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do
ZnC
l2(aq) e gás hidrogênio.
: reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do
ZnC
l2(aq) e gás hidrogênio.
Reação 4:
 a reação de cloreto de bário com sulfao de sódio produz o cloreto de sódio e o sulfato de bário precipitado.
a reação de cloreto de bário com sulfao de sódio produz o cloreto de sódio e o sulfato de bário precipitado.Após analisar essas reações, uma estudante de Química fez as seguintes afirmações:
I – As reações 1 e 3 são de “síntese”, e a reação 2 é de “decomposição”.
II – As reações 3 e 4 são, respectivamente, de “simples troca” e de “dupla troca”.
III – A reação 2 é de decomposição.
IV – A reação 1 é de síntese.
Com base na teoria das classificações das reações químicas, a estudante fez afirmações corretas APENAS em
Uma amostra de 50 mL de solução alcalina de carbonato de sódio foi titulada com ácido clorídrico 1,0 N. Inicialmente, empregando-se fenolftaleína como indicador, foram gastos 30 mL da solução titulante. Após a virada da fenolftaleína, adicionou-se metilorange, e mais 10 mL da solução de HCl. foram consumidos.
Qual a relação molar NaOH/Na2CO3 presente na solução analisada?
O hidrogênio pode ser produzido por eletrólise da água, conforme as reações catódica e anódica indicadas a seguir.
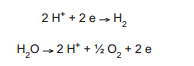
Considere as seguintes afirmativas:
I – Os potenciais normais de eletrodo são independentes do pH.
II – A diferença de potencial normal da célula é independente do pH.
III – Os sobrepotenciais são independentes da composição da solução.
De acordo com o exposto acima, está correto o que se afirma em
A respeito da constante de velocidade (k ) de uma reação
química, analise as afirmações a seguir.
I - Para processos de primeira ordem, a unidade de k é
mol/L s.
II - O valor de k é exatamente igual ao valor da inclina-
ção do gráfi co que relaciona variação da temperatura
em função do tempo.
III - O valor de k refl ete a efi ciência das colisões efetivas
que geram produtos numa reação química.
É correto APENAS o que se afirma em
Na equação abaixo, X representa substituintes.
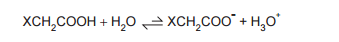
Sobre a acidez desses ácidos orgânicos em solução aquosa, analise as afirmativas a seguir.
I - Substituintes X retiradores de elétrons tendem a aumentar a acidez desses ácidos carboxílicos.
II - Quanto mais estável for a base conjugada, maior a acidez do ácido correspondente.
III - A espécie H3 O+ é o conjugado do ácido carboxílico.
É correto APENAS o que se afirma em
Uma aplicação usual de eletrólise ígnea na indústria é
aquela em que se obtém alumínio a partir do Al23 .
Qual é a corrente elétrica necessária, em ampère, para
depositar no catodo uma massa igual a 2,7 g de alumínio
em 2 horas?
Dado: Carga do elétron: 1,6 x 10-19 C
Constante de Avogadro = 6 x 1023