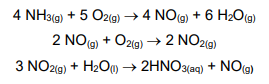O ácido nítrico é muito utilizado pela indústria química, principalmente em processos de nitrificação de compostos orgânicos, na fabricação de vernizes, fertilizantes agrícolas, celuloses, salitre (nitrato de potássio), pólvora negra, trinitrotolueno (TNT), nitroglicerina, seda artificial, ácido benzoico, fibras sintéticas, galvanoplastia, ácido pícrico, nylon, entre outros. A produção industrial de ácido nítrico se dá pelo Processo Ostwald, que envolve as seguintes reações químicas:
Supondo-se que o rendimento esperado nesse processo seja de 90% e que a amônia utilizada apresente 20% de impurezas, a massa de amônia, em toneladas, necessária para obtenção de 6,3 t de ácido nítrico será de, aproximadamente:
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
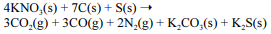
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato de potássio e o cátion do nitrato de alumínio é maior que 250,0 g/mol.
A estimativa de que 70-75% da população mundial podem ser intolerantes à lactose (C12H22O11) levou a uma maior procura por produtos livres desse dissacarídeo naturalmente presente no leite e seus derivados. Esse cenário tem contribuído não apenas com o recente interesse das indústrias de alimentos no desenvolvimento de novos produtos com baixo teor de lactose, mas também impulsionou a recente regulamentação quanto à declaração obrigatória da presença de lactose nos alimentos com mais de 100 miligramas (mg) de lactose para cada 100 gramas ou mililitros do produto. Nesse contexto, assinale a alternativa que apresenta aproximadamente o número de mols de lactose presente em 100 mL de um produto com baixo teor de lactose, contendo 2500 mg de C12H22O11.
(Dados: massas atômicas C=12, H=1, O=16)
Uma mistura de cloreto de cálcio e cloreto de sódio é utilizada para auxiliar no processo de derretimento do gelo em vias públicas de regiões mais frias do Planeta. Um químico, desejando analisar tal mistura, dissolveu 2,4630 g dela em água e precipitou o cálcio com oxalato de sódio. O precipitado foi cuidadosamente filtrado, dissolvido em ácido sulfúrico e titulado com 21,62 mL de solução de permanganato de potássio a 0,10 mol/L. Sabendo que a reação química que ocorre durante a titulação é:
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.
Uma solução é preparada dissolvendo 4,8 kg de um composto de massa molar desconhecida em 120 g de água e tem o ponto de congelação de –1,50 °C. Considerando a constante crioscópica da água igual a 1,86 °C kg H2O/mol do soluto, a massa molecular do composto formado é
Ainda com relação aos indicadores de padrão nacional de qualidade do ar, considere que em uma amostra de 1000 cm3 de ar atmosférico foram encontrados 5 nmols de dióxido de nitrogênio (NO2). Sabendo que o Conselho Nacional de Meio Ambiente (Conama) considera 320 µg.m3 níveis máximos aceitáveis (padrão primário) e 190 µg.m3 níveis desejáveis (padrão secundário) (Resolução CONAMA nº 03, de 28/06/90), assinale a alternativa que apresenta a concentração de NO2 e sua relação com os padrões de qualidade do ar estabelecidos.
(Dados: massa atômica N=14, O=16)
Uma caixa vazia com capacidade de 10 L de volume encontra-se em um ambiente cuja pressão é 1 atm e a temperatura 25ºC.

Um técnico injeta 1 mol de H2(g) e, logo em seguida (sem retirar esse gás), injeta mais 1 mol de He(g). Em relação ao volume em litros do H2(g), do He(g) e da mistura gasosa dentro da caixa, é CORRETO afirmar:
A fermentação da glicose (C 6H12O6) produz etanol (C2H6O) e dióxido de carbono (CO2), conforme a equação química não balanceada abaixo:

(Massas molares (g mol
-1): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
O número de mols presentes em 21,6 gramas de prata é o mesmo que o número de mols contidos em
Um estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq).
Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
Uma mistura que consiste de 12,0 g de Sb 2S3, K2S e Bi2S3 reage completamente com oxigênio molecular, formando-se óxido de antimônio (III), óxido de potássio e óxido de bismuto (III). Sobre esse processo, assinale as afirmações abaixo com V (verdadeiro) ou F (falso).
( ) A massa de óxidos obtida é maior do que 12 g.
( ) Ocorre oxidação dos cátions causada pelo oxigênio molecular.
( ) Ocorre redução do oxigênio molecular.
( ) Formam-se 4 g de cada óxido.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
A fórmula mínima determinada para um composto orgânico foi CH2O. Em um estudo subsequente, determinou-se que a sua massa molar era 180 g . mol-1.
A fórmula molecular do composto é
Qual é a massa, em gramas, de NaCl necessária para precipitar todos os íons prata presentes em 15,0 mL de solução de 0,125 mol L -1 de AgNO3?
(Massas molares (g mol-1): Na = 23; Cl = 35,5; Ag = 108; N = 14; O = 16)
O gás dióxido de enxofre (SO 2) é um dos principais e mais perigosos poluentes ambientais. No Brasil, é usado pelo Conselho Nacional de Meio Ambiente (Conama) como um importante indicador do padrão nacional de qualidade do ar (Resolução CONAMA nº 03, de 28/06/90). Para a adequada interpretação dos dados analíticos na determinação das concentrações de SO2 no ar atmosférico, frequentemente é necessária a conversão de quantidade de matéria presente no ar atmosférico em quantidade de mols. Assim, assinale a alternativa que indica, para uma amostra de ar atmosférico contendo 8g de SO2, aproximadamente, a quantidade de moléculas de SO2 presentes, assim como o número de mols de SO2, respectivamente.
(Dados: número de Avogadro=6,02x1023 ; massa atômica O=16, S=32)
A massa de hidróxido de sódio necessária à preparação de 500 mL de uma solução 0,2 mol/L, é:
Adotar nessa questão, massas atômicas: H = 1, O = 16, Na = 23.