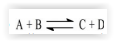A oxigenoterapia consiste na administração suplementar de oxigênio (O2) gasoso a um paciente, com o objetivo de elevar ou manter a saturação de oxigênio aos níveis aceitáveis, corrigindo uma possível deficiência no aporte de oxigênio aos tecidos nesse indivíduo. A quantidade de oxigênio a ser administrada é medida em função do teor de oxigênio no paciente, e as informações sobre a quantidade de mols de O2 são necessárias para a correta aplicação da técnica. A esse respeito, assinale a alternativa que apresenta aproximadamente o número de mols de oxigênio em uma amostra contendo 1,20x1021 moléculas de O2.
(Dados: número de Avogadro=6,02x1023)
Questão anterior:

Ainda a respeito da produção de amônia, conforme reação apresentada anteriormente (questão 52), assinale a alternativa que apresenta, respectivamente, quantas moléculas de H2(g) serão consumidas na reação, considerando que foram consumidas 3,60x1020 moléculas de N2(g), e quantos mols de NH3(g) serão produzidos, se forem empregados 1,2mols de N2.
Uma amostra de sulfato cúprico hidratado pesando 125,2 g foi seca em estufa a 110°C para remover toda a água de hidratação. Após a secagem, a amostra pesou 80,0 g. Então a fórmula do sal hidratado em questão é
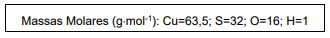
Trifluoreto de boro reage com boridreto de sódio e produz tetrafluorborato de sódio e diborano, que, ao reagir com o oxigênio do ar, produz óxido de boro e água, como representado nas equações químicas não balanceadas:
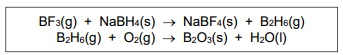
Partindo-se de 111 gramas de boridreto de sódio e considerando que este é o reagente limitante e, ainda, que o rendimento da reação é 90%, a massa, em gramas, de óxido de boro produzido será
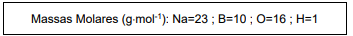
Com base nas seguintes informações, responda a questão.
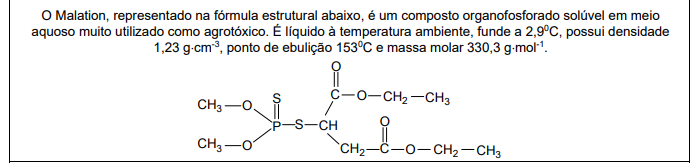
O teor (%) de fósforo em um mol desse composto é de aproximadamente,

Ferro pode ser obtido por redução de óxido férrico com monóxido de carbono, de acordo com a equação Fe2O3 (s) + 3 CO (g) -> 2 Fe (s) + 3 CO2 (g). Considerando essa reação, qual a quantidade mínima necessária de Fe2O3 para se obter 112 g de ferro metálico?
A balança analítica é um dos instrumentos de medida mais usados e importantes no laboratório, pois dela dependem, basicamente, todos os resultados analíticos obtidos. Uma balança analítica típica, tem capacidade entre 100 g e 200 g e sensibilidade entre 0,01 mg a 0,1 mg (Harris, 2017).
Sobre técnicas de pesagem em balança analítica é correto afirmar que
Para que o airbag de um carro possa inflar, pode ser utilizada a decomposição da azida de sódio, de acordo com a equação química não balanceada. Suponha que um airbag utilize 65 gramas de azida de sódio no processo de inflagem.
NaN3 (s) → Na (s) + N2 (g)
Considere os dados:
Massas molares: Na = 23 g/mol; N = 14 g/mol
Volume molar: 22,4 L
Nessas condições, quantos litros do gás serão formados nesse processo?
Que quantidade de glicose é necessária para preparar uma solução a 10% a partir de uma solução de 500 mL de glicose a 5%?
Em uma aula prática, 10 adições de 0,02 mL de uma solução 0,37 mol l-1 de sacarose são feitas em um balão volumétrico de 5 mL contendo 1 mL de água destilada. Após essas adições, a concentração de sacarose no balão, em mol l-1, será de:
Visando determinar o teor de umidade de uma amostra de solo contaminado, um perito recolheu 4,860g de amostra previamente homogeneizada para uma cápsula de porcelana de massa igual a 22,148g. Após 6 horas de secagem em estufa a 110°C, seguida de resfriamento em dessecador até temperatura ambiente, a cápsula contendo a amostra de solo apresentou massa igual a 25,451g. Assinale a alternativa que contém a porcentagem de umidade na amostra de solo analisada.
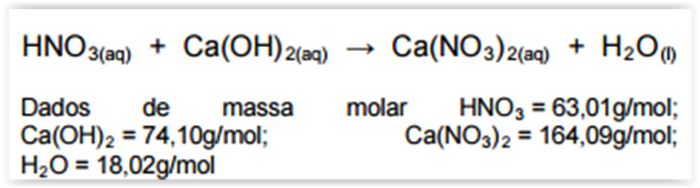
Considerando-se a reação de neutralização total não
balanceada a seguir, assinalar a alternativa CORRETA:
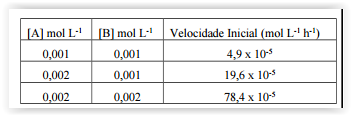
A equação
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3 h-1, é:
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são
também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram col°Cadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?
Um analista precisa preparar uma solução aquosa de 1000 mg l-1 de Th(NO3)4. No almoxarifado, ele tem à sua disposição um frasco contendo Th(NO3)4.5H2O, com indicação de 80% de pureza. Qual é a massa de sal, em gramas, necessária para preparar 1 litro da solução Th(NO3)4?