A hidrazina, N2 H4 , na forma líquida, usada como combustível, é carregada em um dos tanques de um foguete. Para que o foguete seja impulsionado, deve ocorrer a reação com oxigênio, O2 , também na forma líquida, presente em um outro tanque do foguete. A reação ocorre numa câmara, logo acima dos propulsores, na proporção de 1 mol de N2 H4 para 1 mol de O2 , gerando dois produtos, sendo um deles o gás nitrogênio, N2 . Considerando-se que um foguete carrega 3.200 kg de hidrazina, a massa mínima de oxigênio, em kg, que o foguete tem de levar, de modo a reagir com toda a hidrazina existente, e o segundo produto da reação são, respectivamente,
O uso crescente de fibras ópticas para a construção de redes de
telecomunicações em banda larga levou a avanços consideráveis
na tecnologia da fabricação de vidros (...). Os vidros têm estrutura
em rede baseada em um óxido de ametal, normalmente a sílica
(SiO2), fundida juntamente com óxidos de metais que agem como
“modificadores de rede" e alteram o arranjo das ligações do
sólido (...). O vidro resiste ao ataque da maior parte dos
reagentes. Entretanto, a sílica do vidro reage com ácido
fluorídrico para formar íons fluoro‐silicatos:

Na reação apresentada
Alumínio metálico pode ser produzido eletroliticamente pelo processo Hall-Heroult em que o A603 é dissolvido em criolita fundida, Na3AiF6.
Nesse processo o Ion alumínio é reduzido a alumínio metálico e o ion 02 é oxidado a 02, que reage com os anodos de carbono gerando CO2.
A massa de aluminio obtida nessa eletrolise por uma corrente de 8,0A durante 3 horas e 20 minutos e rendimento de 100%, é de:
Dados: Massa molar (g.mor-1): Ai= 27 1F = 96500C
Um filme fotográfico consiste em uma fina película transparente revestida com uma gelatina incolor contendo inúmeros cristaizinhos de um haleto de prata. São os íons Ag presentes nesses sais que desempenham papel fundamental no processo. Como o brometo de prata é muito utilizado, vai-se representar o processo fotográfico, considerando que o haleto presente no filme seja o AgBr. No momento em que o objeto é fotografado, a luz atinge o filme e provoca a reação abaixo:
2Ag+ + 2Br- 2Ag0 + Br2 0
Essa equação pode ser classificada como:
O processo não espontâneo, em que a passagem de uma corrente elétrica através de um sistema líquido, no qual existam íons, produz reações químicas é conhecido como eletrólise.
A eletrólise de uma solução aquosa de NaCl, produz soda cáustica e dois gases que são:
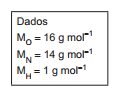
O boro-hidreto é um agente redutor útil, pois a semirreação
esquematizada a seguir, apresenta baixo potencial de redução:
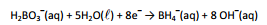
O íon boro-hidreto pode ser utilizado na deposição de níquel a
partir de uma solução contendo Ni2+.
A reação entre o íon boro-hidreto e o Ni2+ ocorre
A célula eletroquímica hipotética, representada por
X (s) │ X2+ (1,00 mol.L–1) ││ Cu2+ (0,01 mol.L–1) │ Cu (s)
apresentou potencial igual 0,686 volts.
Esta célula hipotética foi construída por duas semi‐células, uma
formada por um eletrodo desconhecido imerso em uma solução
de concentração 1,00 mol.L–1 contendo seus cátions X´2+ e outra
formada por um eletrodo de cobre imerso em uma solução
diluída com íons Cu2+ na concentração 0,01 mol.L–1.
Nas condições do enunciado, os eletrodos apresentam os
potenciais padrão:
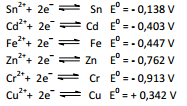
Nestas condições, X é o
O escurecimento de objetos de prata, como baixelas e talheres, é muito comum. Ao se cozinhar demasiadamente os ovos, as proteínas da clara, que contêm átomos de enxofre, liberam o ácido sulfídrico, que na forma gasosa e na presença de oxigênio, na água de cozimento, pode levar à oxidação do objeto de prata, com formação de uma fina camada insolúvel de sulfeto de prata (Ag 2S). O mesmo ocorre quando se cozinham alimentos como o repolho, que contém compostos sulfurados como a cisteína, estrutura representada na figura, que sofre decomposição durante o cozimento, liberando o H2S. As principais reações envolvidas nesse fenômeno são apresentadas nas equações:
A diferença de potencial (ddp) para a reação global que representa o fenômeno do escurecimento dos objetos de prata tem valor igual a:
Busca-se construir uma pilha que apresente diferença de potencial teórica em torno de ΔE = +2,5V. Considere a tabela de potenciais de redução, apresentada a seguir.
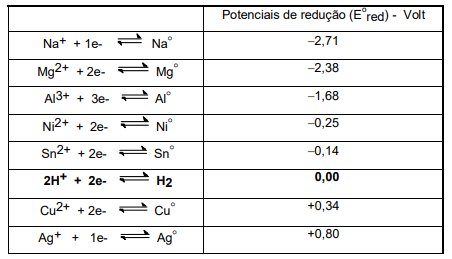
Indique a alternativa que descreve a reação química adequada para produzir a referida pilha.
Uma aplicação usual de eletrólise ígnea na indústria é
aquela em que se obtém alumínio a partir do Al23 .
Qual é a corrente elétrica necessária, em ampère, para
depositar no catodo uma massa igual a 2,7 g de alumínio
em 2 horas?
Dado: Carga do elétron: 1,6 x 10-19 C
Constante de Avogadro = 6 x 1023
Dicromato de potássio em solução aquosa e em meio ácido
pode ser utilizado como padrão na determinação de
peróxido de hidrogênio em análises de amostras de água
oxigenada, de acordo com a equação incompleta abaixo.
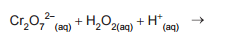
Sobre a reação acima, analise as afirmações a seguir.
I - H2(g) é um dos produtos da reação.
II - O2(g) é um dos produtos da reação.
III - Cr2 O7 2- é o agente redutor, pois cede elétrons ao H + .
IV - H2 O2 é o agente oxidante, pois ganha elétrons do Cr2 O7 2- .
Está correto APENAS o que se afirma em
Um dos bafômetros utilizados para medir a quantidade de
etanol (CH3 CH2 OH) exalado pelos motoristas é baseado
na oxidação do etanol com uma solução ácida de dicromato (Cr2 O7 2- ) a 25°C. Na medição, a cor da solução
muda de laranja, característico do Cr2 O7 2- , para o verde do Cr3+. A mudança de cor, que é um processo de transferência de elétrons espontâneo, indica a presença de álcool
no sangue.
A esse respeito, considere as semirreações abaixo.
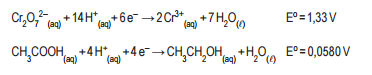
O valor do potencial padrão desse sistema é

