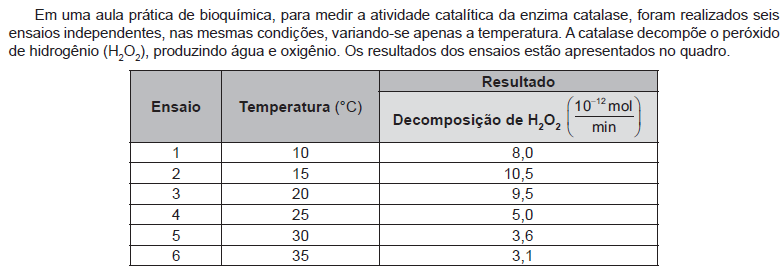
Para demonstrar os processos físicos de separação de componentes em misturas complexas, um professor de química apresentou para seus alunos uma mistura de limalha de ferro, areia, cloreto de sódio, bolinhas de isopor e grãos de feijão. Os componentes foram separados em
etapas, na seguinte ordem:
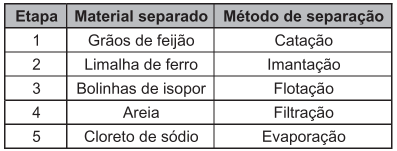
Em qual etapa foi necessário adicionar água para dar sequência às separações?
Um produto, obtido industrialmente da eletrólise de solução aquosa de cloreto de sódio, tem sido amplamente empregado na indústria, por exemplo, na fabricação de papéis, tecidos e sabões. Normalmente, esse produto é usado na desobstrução de encanamentos e sumidouros,
pois é capaz de reagir com gorduras. No entanto, a sua manipulação exige cuidados, pois é altamente corrosivo, podendo, em contato com a pele, provocar vermelhidão, irritação ou “queimaduras” de tecidos vivos. Além disso, se o frasco do produto for abandonado aberto por um longo
período de tempo, ele pode absorver CO2, convertendo-se em um sal.
Esse produto industrial é o
As plantas realizam fotossíntese pela captura do gás carbônico atmosférico e, juntamente com a água e a luz solar, produzem os carboidratos. No esquema está apresentada a equação desse processo, em que as letras x e y representam os coeficientes estequiométricos da reação.
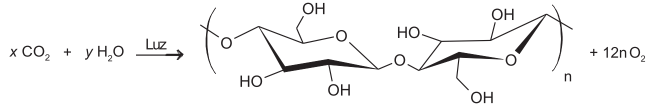
Quais são os valores dos coeficientes x e y da equação balanceada de produção do carboidrato e oxigênio?
Considerando a diferença de massa mencionada entre os dois isótopos, que tipo de procedimento alternativo ao da efusão pode ser empregado para tal finalidade?
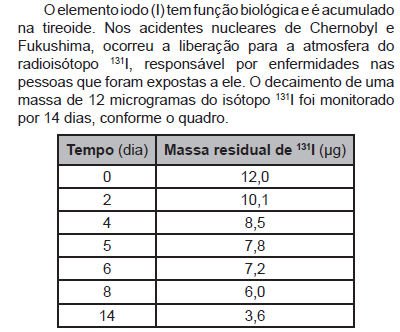
Após o período de 40 dias, a massa residual desse isótopo é mais próxima de
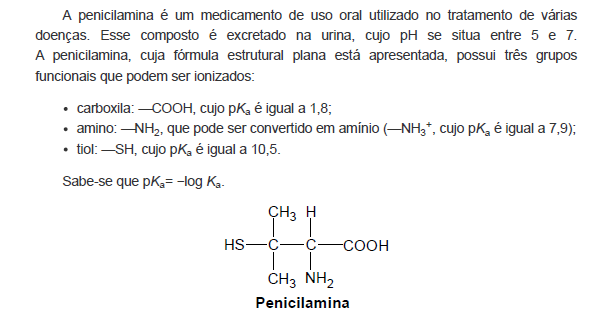
Qual estrutura derivada da penicilamina é predominantemente encontrada na urina?
Segundo a propaganda de uma rede de hotéis, “milhões de toneladas de detergentes são lançados na natureza para a lavagem de toalhas utilizadas uma única vez”. Num projeto para reduzir os impactos ambientais da lavagem de toalhas, além de incentivar a sua reutilização, a rede implementou melhorias no processo de lavagem e substituição dos surfactantes sintéticos por biossurfactantes.
A vantagem do uso de biossurfactantes na rede de hotéis seria
O biodiesel é um combustível alternativo ao diesel de petróleo que tem sido produzido em grande escala no Brasil a partir da transesterificação do óleo de soja em meio alcalino. Visando reduzir a competição com a indústria alimentícia, os óleos de fritura estão entre as matérias-primas alternativas que têm sido consideradas. Porém, o seu uso no processo tradicional é dificultado por causa da acidez de Brönsted, desenvolvida durante o processo de degradação do óleo, conforme mostra o esquema genérico em que R representa um grupamento alquila qualquer.
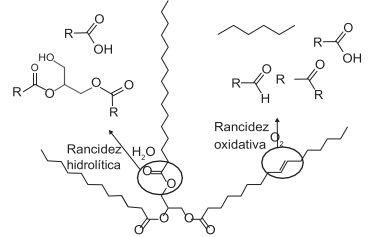
A dificuldade mencionada é gerada pela presença de grupamentos:
Polímeros biodegradáveis são polímeros nos quais a degradação resulta da ação de microrganismos de ocorrência natural, como bactérias, fungos e algas, podendo ser consumidos em semanas ou meses sob condições favoráveis de biodegradação. Na ausência de oxigênio, ocorre a biodegradação anaeróbica, conforme representação esquemática simplificada.
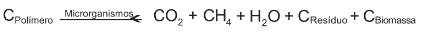
Durante esse processo, há a formação de produtos que podem ser usados para a geração de energia. Um desses produtos é encontrado no estado físico de menor agregação da matéria e pode ser diretamente usado como combustível.
BRITO, G. F. et al. Biopolímeros, polímeros biodegradáveis e polímeros verdes.
Revista Eletrônica de Materiais e Processos, n. 2, 2011 (adaptado).
O produto que apresenta essas características é:
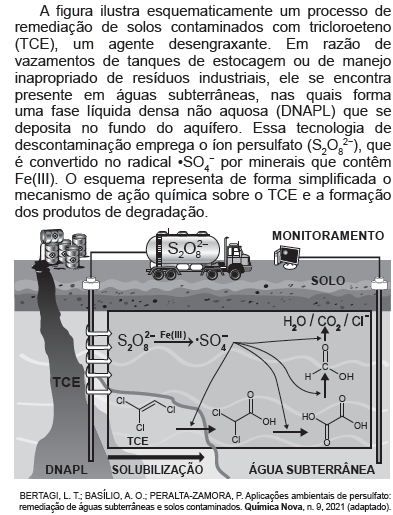
Esse procedimento de remediação de águas subterrâneas baseia-se em reações de
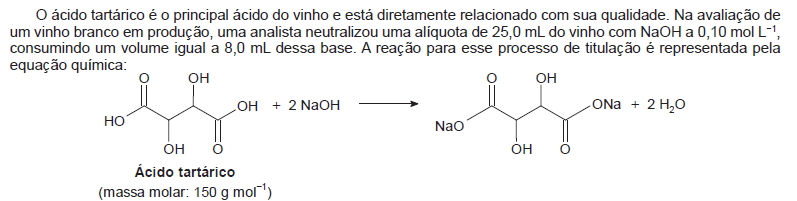
A concentração de ácido tartárico no vinho analisado é mais próxima de:
O consumo excessivo de sal de cozinha é responsável por várias doenças, entre elas a hipertensão arterial. O sal rosa é uma novidade culinária pelo seu baixo teor de sódio se comparado a de outros sais. Cada 1 g desse sal contém cerca de 230 mg de sódio contra os cerca de
400 mg de sódio encontrados nessa mesma quantidade de um sal de cozinha tradicional. Estima-se que no Brasil a dose diária de consumo de sal de cozinha seja de 12 g, e a dose máxima recomendada é de menos de 5 g por dia. Considere a massa molar do sódio igual a 23 g/mol.
MILL, J. G. et al. Estimativa do consumo de sal pela população brasileira: resultado da
Pesquisa Nacional de Saúde 2013. Rev. Bras. Epidemiol., n. 22, 2019 (adaptado).
Considerando-se a dose estimada de consumo de sal de cozinha no Brasil, em 30 dias um indivíduo que substituir o sal de cozinha tradicional pelo sal rosa promove uma redução na quantidade de sódio ingerida, em mol, mais próxima de
A densidade é uma propriedade que relaciona massa e volume de um material. Um estudante iniciou um procedimento de determinação da densidade de uma amostra sólida desconhecida. Primeiro ele determinou a massa da amostra, obtendo 27,8 g. Em seguida, utilizou
uma proveta, graduada em mililitro, com água para determinar o volume da amostra, conforme esquematizado na figura. Considere a densidade da água igual a 1 g/mL.
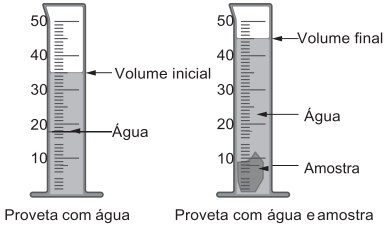
A densidade da amostra obtida, em g/mL, é mais próxima de