Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
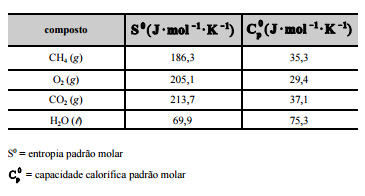
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando–se que as capacidades caloríficas fornecidas na
tabela sejam válidas para o intervalo de temperaturas entre
25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g)
deverá liberar maior quantidade de calor se for realizada a
35 ºC, e não a 25 ºC.
Em uma reação química a variação da entalpia é sempre a mesma, quer ela ocorra em uma única etapa ou em várias. A variação da entalpia depende somente dos estados inicial e final. Esse conceito é conhecido como a lei de:
A queima de um palito de fósforo é uma reação de combustão que pode ser representada, simplificadamente, por:
Madeira + oxigênio → gás carbônico + água + calor
Nessa reação ocorre liberação de energia na forma de calor. Uma pergunta interessante sobre a reação é: De onde veio essa energia? A energia liberada estava contida nos reagentes e, quando eles se transformaram nos produtos, essa energia foi liberada.
Isso permite concluir que cada substância deve apresentar certo conteúdo de energia, que é denominada:
Uma reação com catalisador é mais rápida em relação à mesma reação sem catalisador porque

