Dadas as equações termoquímicas:
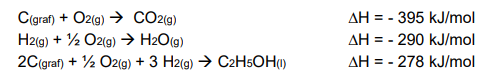
A entalpia padrão de combustão do etanol é:
Observe o gráfico
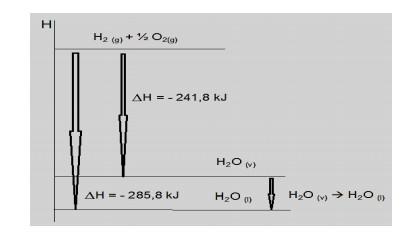
O calor envolvido na vaporização de 1 mol de água em kJ é:
Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Se, na queima de um artefato pirotécnico ocorrer a decomposição do carbonato de bário, de acordo com a reação química BaCO 3(s) → BaO(s) + CO2(g), então a entalpia padrão dessa reação de decomposição (ΔHx), calculada a partir dos dados listados na tabela seguinte, será ΔHx = ΔH1 - ΔH2 + ΔH3.
Analise as afirmativas a seguir sobre termoquímica.
I. Em uma reação endotérmica, a entalpia do sistema reativo cresce, ou seja, a entalpia dos produtos é maior do que a entalpia dos reagentes.
II. A lei da conservação de energia estabelece que a energia não é criada nem destruída em uma mudança de estado físico.
III. A variação de entalpia da reação depende do caminho que as reações ocorrem – Lei de Hess.
Está(Estão) correta(s) a(s) afirmativa(s)
Sobre a termoquímica, é correto afirmar que
A partir das equações termodinâmicas a seguir, determine o calor padrão de formação do óxido de cobre sólido e assinale a alternativa que contém seu valor CORRETO.
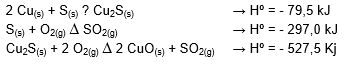
Acerca da termoquímica, da espontaneidade de reações e da
ação de catalisadores, julgue os itens a seguir.
Um catalisador é uma substância que aumenta a velocidade de uma reação sem ser consumida durante ela. Um catalisador é homogêneo se está presente em uma fase diferente da dos reagentes e é heterogêneo se está presente na mesma fase dos reagentes.
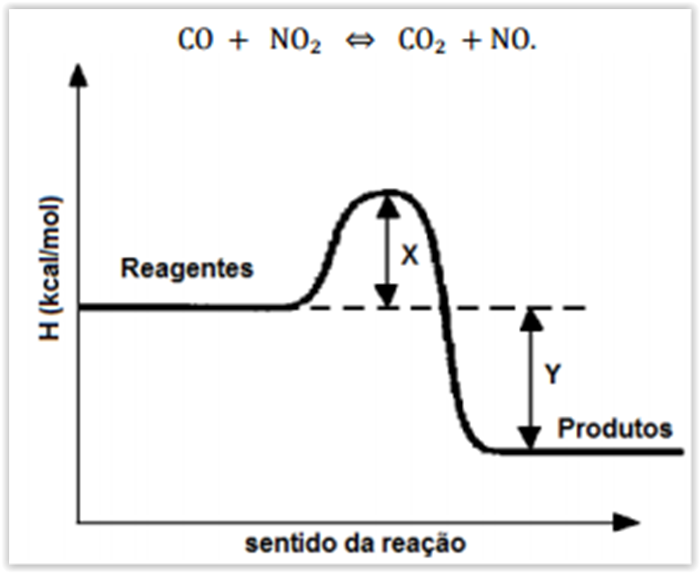
O gráfico abaixo representa a variação de energia potencial quando ocorre a oxidação do monóxido de carbono,
pela ação do dióxido de nitrogênio, segundo a reação química:
Quanto à situação descrita, analisar os itens abaixo:
I - Na reação direta, X representa a energia de ativação da reação.
II - Na reação direta, Y representa a energia absorvida pela reação.
III - A reação indireta é endotérmica.
Está(ão) CORRETO(S):
Considere uma pessoa adulta, em repouso, com um gasto
energético de 2000 kcal e consumo de 2500 kcal em um dia, na
forma de alimentos. Suponha, também, que 70% do seu peso
corporal de 80 kg vem da água que constitui seu corpo. Calcule
a energia, em kcal, que o corpo humano teria em excesso se,
além do repouso, a temperatura da água corporal aumentasse
de 36,5 para 38 oC:
Considere que 1 cal equivale à energia
necessária para elevar de 1 °C a temperatura
de 1 g de água
A respeito das propriedades químicas e físicas de determinados combustíveis, julgue o próximo item.
A gasolina é uma substância orgânica que reage com o oxigênio do ar.
Sobre termoquímica julgue as sentenças a seguir.
I. A entalpia padrão de formação (H
f0) de uma substância simples em sua forma alotrópica mais estável, em seu estado físico mais estável a 1 atm de pressão e a temperatura de 25°C (273 K) por convenção é igual a zero.
II. Uma reação que apresenta uma variação de entalpia negativa (ΔH < O) é chamada de reação endotérmica.
III. O cálculo da variação de entalpia de uma reação (Δ0H) é dado pela fórmula: ΔH = ΔHreagentes -ΔHprodutos
Está(ão) correta(s) a(s) sentença(s)
Em 1937 ocorreu o desastre do Hindenburg em Nova Jersey. O dirigível alemão, cheio de hidrogênio gasoso, foi destruído em um incêndio de grandes proporções. São dadas as seguintes proposições sobre o fenômeno.
I. Trata-se de uma reação exotérmica, na qual a energia de ativação é diretamente proporcional a quantidade de matéria presente, onde o total de entalpia liberada é igual ao produto da quantidade de matéria pelo volume total do dirigível.
II. A variação de entropia do sistema em questão (dirigível), ao entrar em combustão, é dado pela quantidade de calor produzida acrescida do trabalho realizado para expansão dos gases durante a explosão.
III. Considerando comportamento do hidrogênio como um gás ideal e a invariabilidade do volume do dirigível, antes da explosão não há realização de trabalho por parte do gás. São CORRETAS as alternativas:
O ácido fosfórico (H3PO4) de alta pureza é obtido por vIa seca ou térmica, pela combustão do fósforo elementar e posterior
hidratação do P2O5, de acordo com as reações abaixo:
Nesse pr°Cesso, de acordo com as equações acima, assinale a alternativa que apresenta a quantidade de calor liberado
na formação do H3PO4 (em kcal/mol).
Ao realizar-se a vistoria em um aterro sanitário, o fiscal
verificou que o aterro utilizava o gás metano produzido
para queima, gerando calor em um forno. Para assar um
bolo, foram consumidos 3.500g de metano. Determine qual
a quantidade de calor (em módulo) produzida no forno
para assar o bolo.
Dados:
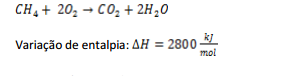
Massas atômicas relativas:
C = 12
H = 1
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
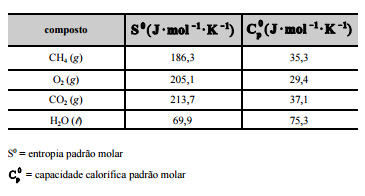
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Se o consumo mensal de energia elétrica da referida empresa
for de 1,0 × 1012 J, a combustão do CH4 (g), sob pressão
constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
CO2 para suprir as necessidades mensais de energia da
empresa.