O estagiário do laboratório de química, sob supervisão do técnico, preparou uma solução de hidróxido de sódio com concentração de 0,01 mol/L. Visto que essa solução foi utilizada em uma aula de medição de pH, qual o valor do potencial hidrogênio iônico dessa solução?
O pH (potencial hidrogeniônico) é calculado como o logarítimo negativo da concentração de íons de hidrogênio de uma solução. Sua escala varia de 0 a 14, tendo sete como o ponto de neutralidade. Sobre o pH da água de viveiros escavados utilizados para piscicultura, é correto afirmar que
Atenção: Para responder à questão, considere a curva de titulação abaixo.
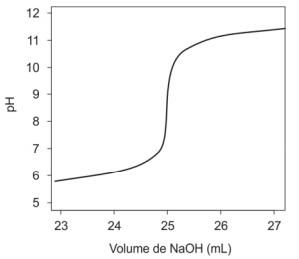
O valor de pH obtido no ponto estequiométrico deve-se a
Qual é o pH de uma solução-tampão preparada pela adição de 0,060 mol de ácido lático e 0,050 mol de lactato de sódio em 500 mL de água?
(Informações adicionais: pH = pKa + log [A- ]/[HA]; - log Ka = 3,85; log 0,83 = -0,08; log 1,2 = +0,08; log 1 = 0)
A respeito dos conhecimentos básicos necessários para a correta preparação e aplicação de soluções tampão, assinale V para as afirmações verdadeiras, ou F para as falsas.
( ) Solução tampão é uma mistura de um ácido fraco e sua base conjugada, ou uma base fraca e seu ácido conjugado.
( ) A diluição de uma solução tampão ou a adição de pequenas quantidades de ácidos ou bases provoca uma grande variação no pH final dessa solução.
( ) Para a manutenção do pH adequado em um experimento de digestão alcalina, a tripsina, que apresenta pH ótimo em torno de 8, deve ser incubada, preferencialmente, em solução tampão pH 6 ao invés de pH 9.
( ) Uma solução tampão pode ser preparada pela combinação de quantidades calculadas de um par ácido-base conjugado adequado.
A sequência correta, de cima para baixo, é:
Julgue o item a seguir, relativo a ácidos e bases.
A solução‐tampão é aquela cujo pH é mantido constante quando pequenas quantidades de ácido ou base são adicionadas. Um tampão básico, que estabiliza soluções em pH > 7, é preparado com uma solução que contém CH3COOH e CH3CO2−.
Analise o texto a seguir, a respeito do funcionamento básico de um equipamento rotineiramente usado em laboratório de química. A qual equipamento o texto se refere?

Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Todo par ácido fraco/base conjugada pode agir mais eficientemente como tampão em valores de pH próximos à neutralidade (pH = 7).
Em um experimento de química, um estudante colocou em um recipiente 500 mL de uma solução aquosa de hidróxido de sódio (NaOH) em uma chapa de aquecimento. O pOH da solução antes do aquecimento era igual a 2. Após um tempo, considerando que se evaporou apenas água, o pOH da solução se reduziu à metade.
Nessas condições, é correto afirmar que o volume, em mililitros, da solução que permaneceu no recipiente ao fim do experimento é igual a
Os ácidos e bases são importantes em diversos processos químicos que ocorrem ao nosso redor, desde os industriais até os biológicos. Essas substâncias foram primeiro identificadas pelas propriedades de suas soluções aquosas.

Considerando a dissociação de um ácido genérico (HA) em água, conforme a equação mostrada acima, identifique como verdadeiras “V" ou falsas “F" as seguintes afirmativas:
( ) Se HA = HCl, ele estará completamente dissociado e a [H3O+] = [HCl]inicial.
( ) HA é o ácido conjugado da H2O enquanto H3O+ é o ácido conjugado de A-.
( ) HA é um ácido de Bronsted-Lowry e H2O é uma base de Bronsted-Lowry.
( ) Se HA = ácido acético, ele estará completamente dissociado e a [H3O+] = [ácido acético]inicial.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Considere as substâncias a seguir.
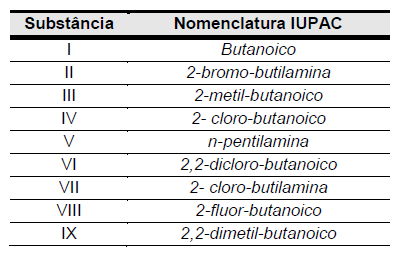
Se organizadas em ordem crescente de valores de pKa, temos a sequência
A quantificação do ácido acético em vinagre comercial pode ser realizada por titulação de solução de vinagre com hidróxido de sódio de concentração aproximada de 0,1 mol.L-1 , empregando-se fenoftaleína como indicador. Sobre essa titulação, é correto afirmar que:
Eletrodos de prata/cloreto de prata são amplamente utilizados em Potenciometria para registros de pH e de potencial do meio. Uma das características desse eletrodo é
Atenção: Para responder à questão, considere a curva de titulação abaixo.

O gráfico representa a titulação de
Uma solução de ácido sulfúrico é preparada a partir de 9,8g de ácido sulfúrico, com pureza de 100%, acrescentando-se o ácido sobre a água destilada. Qual o volume de água, em litros, que deve ser adicionado à solução para que o pH final seja 2? (Dados: H = 1; S = 32; O = 16)

