No laboratório de uma escola pública, um estudante do Ensino Médio dissolveu 0,4 mol de um monoácido HA em 1,0 L de água destilada. Sabendo que a constante de ionização da base A- é 4,0x10-11, a 25 ºC, assinale a alternativa que apresenta o correto valor do pH, a 25ºC, da solução preparada pelo referido estudante.
Considere a seguinte situação:
Uma solução apresenta pH=9,0.
O reagente indicado para se ajustar o pH dessa solução a pH=7,0 está apresentado na alternativa:
Uma solução de HCl 5x10 -8 mol L-1 foi preparada em água à temperatura ambiente. Considerando o valor da constante do produto iônico da água (Kw) igual a 1x10-14, a percentagem de íons H+ proveniente da solução de HCl é igual a
Uma mistura equimolar de acetato de sódio e ácido acético foi preparada em água para formar uma solução tampão. Considerando o Ka do ácido acético igual a 2x10-5, o pH da solução preparada apresentou valor igual a
O índice de acidez (Ia ) de óleos e gorduras é um dos parâmetros para a determinação de sua qualidade, visto que, quanto maior o grau de decomposição dos lipídeos, mais alta é sua acidez. Na determinação do Ia, uma quantidade conhecida de amostra (mA ) é dissolvida num solvente aproprIado (p.e. etanol) e titulada com uma solução padronizada de NaOH de concentração CB, utilizando-se fenolftaleína como indicador. Sabendo que o Ia é definido como a massa de KOH (em miligramas) necessárIa para neutralizar 1 grama de amostra, dado pela equação Ia = mKOH(mg) / mA(g ), e que o volume de solução de NaOH utilizado na titulação é VB, assinale a alternativa que apresenta a expressão para o cálculo do Ia, de acordo com os dados obtidos experimentalmente. Dados: massa molar do KOH = 56,1 g/mol
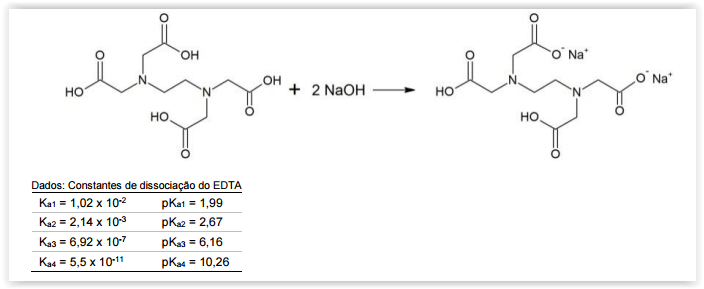
O ácido etilenodIamino tetra-acético (EDTA) é usado como “sequestrante" em detergentes, impedindo a precipitação do
surfactante (princípio ativo) pelos íons Ca+2, Mg+2 e Fe+3 presentes na água. Em análise química, o EDTA é utilizado como
titulante para a determinação de dureza (Ca+2, Mg+2) de águas, cujo sal dissódico é obtido pela seguinte reação:
De acordo com a reação de neutralização parcIal do EDTA acima apresentada, assinale a alternativa que apresenta o
intervalo de pH no qual é obtido apenas o sal dissódico.
Para preparar uma solução aquosa de cloreto de sódio com concentração c(NaCl)=0,01 mol/L, é preciso pesar gramas do soluto e dissolvê-lo numa determinada quantidade de água. Em relação a esse procedimento,
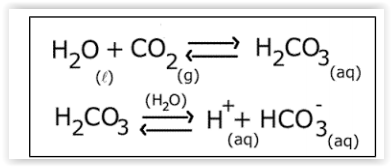
As reações a seguir representam o sistema de
tamponamento sanguíneo do bicarbonato
O aumento no pH sanguíneo resulta
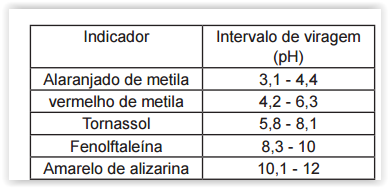
Deseja-se titular 50 mL de uma solução
aquosa de amoníaco (0,3 mol L-1), NH3 ( Kb = 1,8x 10-5), com HCl 0,3 mol L-1. Para isso, com base
nas informações da lista abaixo, qual indicador
deve ser usado para para essa titulação?
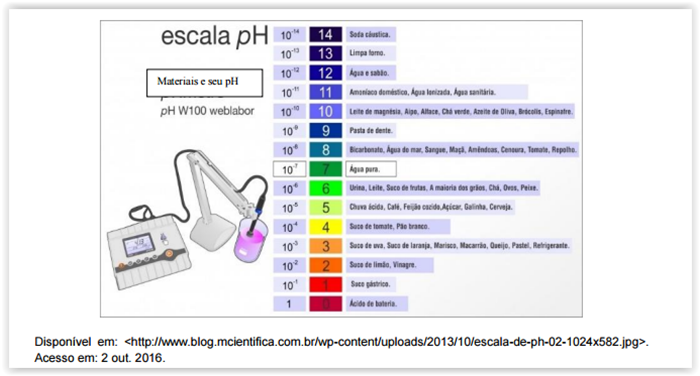
Considere a figura a seguir.
A figura apresenta a escala de pH de vários materiais conhecidos cotidianamente.
Essa grandeza
Durante uma vistoria, o fiscal analisa uma solução cuja
concentração hidrogeniônica é igual a 4,5 x 10-8
íons-g/l.
Qual é o valor do pH dessa solução?
Adotar: log(4,5) = 0,65
Sabendo que a 25°C uma solução 0,025 mol L-1 de amônia apresenta 3,7% de ionização, pode-se dizer que depois que forem adicionados 0,0090 mol de NH4 Cl a 1 L dessa solução, a concentração do OH- é:
Um analista recebeu uma solução de NaOH 0,5 mol/L (NaOH – MM = 40 g/mol) para ser padronizada. Nesta padronização, foi usado, adequadamente como padrão primário, o ácido oxálico dihidratado (H2C2O4 . 2H2O – MM = 126,07 g/mol) convenientemente preparado. O analista mediu uma massa equivalente a 0,8303 g de ácido oxálico dihidratado e a diluiu em 100 mL de água em um Erlenmeyer, adicionando algumas gotas de fenolftaleína. O analista encheu uma bureta de 50 mL com a solução de NaOH e iniciou a titulação dos 100 mL da solução de ácido oxálico. O ponto de viragem, em que a fenolftaleína tornou‐se violeta, foi alcançado quando o volume NaOH da bureta era de 27,3 mL e a titulação parou. Assinale a alternativa que apresenta o valor da concentração padrão de NaOH.
Uma solução de acetato de sódio (NaC2H3 O2) foi
preparada de modo que sua concentração é
0,1 mol/L.Aequação que representa sua hidrólise é:
C2H4O2-+ H2O > C2H4O2+ OH-
Sabendo-se que:
KC2H4O2 = 1,8.10-5 ; Kw = 1,0.10-14 e log 1,3 = 0,114, o
pH desta solução é:
Certa solução aquosa a 25°C apresenta [OH-] = 10 -10 mol/L. Essa solução apresenta pH: