Uma solução tampão é usualmente constituído pela combinação de um ácido ou base fraco e um sal originado do mesmo ácido ou base. Entretanto, é possível constituir-se uma solução tampão a partir de um único componente. Um exemplo de um composto que, sozinho em solução, é capaz de agir como um tampão, é
Julgue o item a seguir, relativo a ácidos e bases.
Indicadores ácido‐base são comumente utilizados nas titulações de ácidos e bases, sejam fracos ou fortes. O indicador é um ácido ou uma base cujas espécies protonadas (ou desprotonadas) têm cores diferentes. Em solução aquosa, o comportamento de um indicador depende essencialmente do valor de pH.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Por ser um ácido fraco, o ácido lático dissocia-se parcialmente em água, formando lactato e H+, até atingir um equilíbrio químico.
O phmetro é um dispositivo simples e rápido, utilizado para medir a acidez e alcalinidade de um fluido. Um medidor de pH funciona como um voltímetro que mede a
O termo pH foi utilizado pela primeira vez em 1909 pelo bioquímico dinamarquês Sören Peter Lauritz (1868-1939). A pHmetria é um exame feito em pacientes com suspeita de refluxo para detectar a presença de ácido no esôfago. Sobre esse importante conceito, é correto afirmar que
Em muitas situações de tratamento de águas, ocorre a necessidade de se alterar o valor do pH do meio, de forma a atender a determinadas exigências. O composto mais adequado para elevar o pH de um reator anaeróbio desequilibrado é
O eletrodo de vidro é o mais utilizado na determinação do pH. Quando a membrana de vidro está imersa em uma solução, o seu funcionamento baseia-se na variação
O pH das soluções é um parâmetro que influencia diretamente as análises químicas e deve ser observado cuidadosamente. Nesse sentido, a cromatografia líquida de alta eficiência no modo reverso emprega, frequentemente, fases móveis aquosas constituídas de soluções tampão. A esse respeito, assinale V para as afirmações verdadeiras, ou F para as falsas.
( ) Variações de pH afetam as análises cromatográficas, pois podem levar a significativas mudanças no estado de ionização e solubilidade de muitas moléculas após interferência no equilíbrio ácido-base das reações.
( ) Na cromatografia, uma solução tampão é escolhida como fase móvel para aumentar a precisão analítica, pois o tampão resiste a mudanças de pH, mesmo que grandes quantidades de ácidos ou bases sejam adicionados.
( ) O pH da solução tampão independe da sua diluição, uma vez que a concentração de cada componente da solução tampão varia proporcionalmente com uma variação de volume. Assim, na cromatografia no modo reverso, o ideal é preparar um tampão concentrado e dilui-lo quantas vezes forem necessárias, para otimizar a fase móvel.
( ) A capacidade tamponante aumenta à medida que a razão entre as concentrações do ácido e da base conjugada se torna maior ou menor que a unidade. Assim o pKa do ácido escolhido dever estar entre ± 1 unidade do pH desejado na solução, para que o tampão tenha uma capacidade razoável.
A sequência correta, de cima para baixo, é:
Ácidos e bases são substâncias essenciais em diversas aplicações da química. Para uma aula experimental, foram utilizadas duas soluções, uma de ácido sulfúrico (H2SO4) 0,01 mol L−1, e outra de hidróxido de potássio (KOH) 1,30 mol L−1. Para o experimento, foram misturados 100 mL da solução ácida e 10 mL da solução básica, sendo analisado o comportamento da reação.
Com base nessa situação hipotética, assinale a alternativa que apresenta o valor do pH da solução formada após a realização da mistura.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Eletrólitos são substâncias que se ionizam em água, formando cátions e ânions.
Uma das definições para ácidos é uma substância que, quando adicionada à água, produz hidrogênio (H+). Sobre os ácidos, assinale a alternativa correta:
Considere as duas soluções aquosas ácidas apresentadas a seguir:
I. Ácido sulfúrico (H2SO4), um ácido forte (α = 100%), 0,1 mol/L.
II. Ácido acético (CH3COOH), um ácido fraco (α = 10%), 0,1 mol/L.
O pOH do ácido sulfúrico e o pH do ácido acético são respectivamente
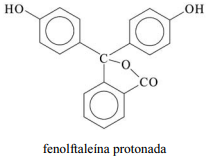
A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
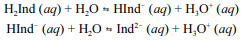
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
Considerando que a fenolftaleína seja incolor em pH reduzido e rosa em pH elevado, infere-se que a forma protonada da fenolftaleína é a que apresenta coloração rosa.
O ácido benzoico (C 6H5COOH) é usado na produção do benzoato de sódio, um dos conservantes mais empregados na indústria dos alimentos, devido a sua propriedade antimicrobiana. Assinale a alternativa que apresenta o valor aproximado do pH de um solução de 0,1 mol.L-1 C6H5COOH, supondo que o grau de ionização (α) desse ácido é igual a 6,4x10-5.
(Dados: log 6,4=0,81)
Soluções aquosas que contêm um par ácido-base conjugado fraco podem resistir drasticamente às variações de pH com a adição de pequenas quantidades de ácido ou base forte. Elas são chamadas de soluções-tampão (ou simplesmente tampão). Nesse sentido, qual é a quantidade de matéria, em mol, de NH 4Cl que deve ser adicionada a 2,0 L de 0,10 mol L-1 de NH3 para formar um tampão cujo pH é 9,00? Suponha que a adição de NH4Cl não altere o volume da solução.
(Dados: Kb = 1,8 x 10-5 ; pOH = 14,00 – pH)

