Sobre as propriedades físico-químicas dos compostos orgânicos, assinale a afirmativa correta:
A eluição por gradiente melhora a separação dos componentes da matriz em métodos de cromatografia líquida e pode-se obter esse gradiente por aumento do/da
Dentre as substâncias relacionadas no quadro a seguir, aquela que tem o maior ponto de fusão, aquela que tem a maior basicidade e aquela que possui menor ponto de ebulição são, respectivamente, as substâncias apresentadas nos itens

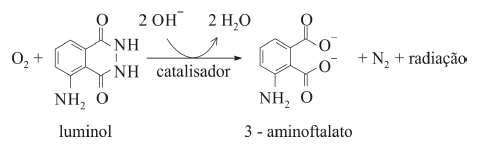
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
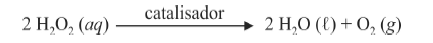
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
No ânion 3-aminoftalato, todos os átomos de carbono, nitrogênio e oxigênio se encontram em um mesmo plano.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
As moléculas NH3 e BH3 apresentam diferentes geometrias moleculares.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A dissolução do gás carbônico na água para formação de água gasosa se dá pela interação entre as moléculas de H2O e CO2, por meio de forças intermoleculares do tipo dipolo-dipolo.
Considerando as substâncias formadas pela ligação química de um átomo de carbono com i) 4 átomos de hidrogênio, ii) dois átomos de oxigênio e iii) um átomo de oxigênio e dois de hidrogênio, tem-se as afirmativas:
I- Uma das moléculas formadas apresenta geometria trigonal plana.
II- Uma delas possui ângulo de ligação igual a 104,5 °.
III- Todos são moléculas polares.
IV- Entre as forças intermoleculares presentes, não há, em nenhum caso, ligação de hidrogênio.
V- O composto formado por carbono e oxigênio deve apresentar o menor ponto de fusão entre os três.
Está correto o que se afirma em
Considerando as espécies químicas H +, Cu+, Mg2+, BF3, Au+, NH4+, BH3, F-, NH3, I- e C6H6, responda às questão.
Sobre as espécies apresentadas não se pode afirmar que
Os compostos 1-butanol e etoxietano são isômeros. Sobre esses compostos, assinale a alternativa correta.
Com relação às características químicas do elemento enxofre S, um dos elementos mais conhecidos, assinale a alternativa correta.
A água é um elemento químico muito abundante e comum, essencial para a vida, tanto na composição corporal dos seres vivos quanto na importância climática em nível planetário. Sabe-se que a molécula de água é formada por duas ligações covalentes entre os átomos de oxigênio e hidrogênio, porém não percebemos suas características incomuns (também chamadas de anômalas). Dentre as características da água apresentadas a seguir, analise as proposições atribuindo valores Verdadeiro V ou Falso F.
( ) A molécula de água é formada por duas ligações covalentes em um ângulo de aproximadamente 105 o com o hidrogênio, apresentando assim uma polaridade. E pela existência dessa polaridade, a moléculas de água diferentes são capazes de formar as ligações de hidrogênio.
( ) A formação de ligações de hidrogênio são responsáveis pela alta temperatura de ebulição, se comparado com elementos de seu grupo (ou família), como por exemplo o H2S.
( ) A água se torna menos densa quando congela.
( ) O calor específico da água é baixo, para que ocorra os ciclos hidrológicos na Terra
Assinale a alternativa que apresenta, de cima para baixo, a sequência correta:
Pelo modelo de repulsão de pares de eletrônicos da camada de valência, regiões de densidade eletrônica aumentada assumem posições tão separadas quanto possível e a geometria da molécula é identificada, referindo‐se às localizações dos átomos na estrutura resultante. Conforme esse modelo, a geometria da molécula de SF6 é
Considere os números atômicos dos seguintes elementos (escritos entre parênteses): oxigênio (8), Na (11), Mg (12), S (16) e Cl (17). Julgue as afirmativas a seguir, sobre os óxidos formados por estes elementos.
I – Aqueles com maior ponto de fusão são os óxidos de sódio e magnésio.
II – O enxofre forma mais de um óxido.
III – A ligação entre Mg e O é a que apresenta maior caráter iônico.
IV – O dióxido de cloro (ClO2) apresenta fórmulas de Lewis com híbridos de ressonância.
Está correto o que se afirma em
Julgue as afirmativas a seguir, sobre a fórmula do eugenol.
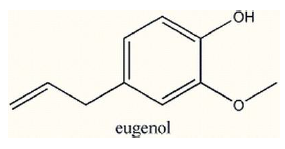
I- Apresenta as funções álcool e éter.
II- Seu hidrogênio ionizável é aquele ligado diretamente ao átomo de oxigênio.
III- Possui fórmula molecular C10H12O2.
IV- Há apenas forças de Van der Waals como forças intermoleculares.
V- Possui a função éster.
Está INCORRETO o que se afirma em
Considere as substâncias a seguir para responder a questão.
I- Fenilamina
II- Fenol
III- Benzeno
IV- Acetofenona (fenil-metil cetona)
V- para-metilbenzoico
VI- ciclohexamina
VII- para-clorobenzoico
VIII- orto, para-diclorobenzoico
IX- benzoico
A ordem crescente de polaridade dos compostos de I a V é