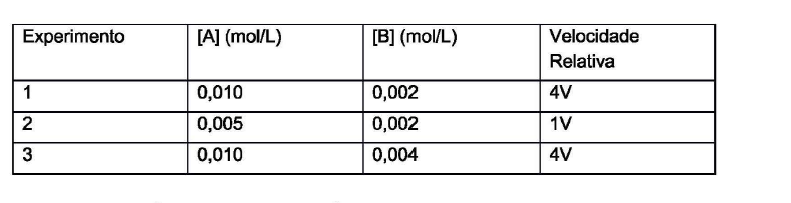
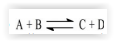Uma reação química foi realizada a uma temperatura Te a uma pressão p. A reação é do tipo A+ B → C. Foram realizados três experimentos na qual se obteve uma velocidade de reação conforme indicado
A partir dessas informações podemos afirmar que:
A equação
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
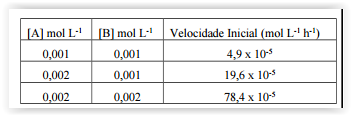
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3 h-1, é:
O diagrama abaixo representa a variação de energia durante a reação: A  B. Assinale a alternativa que corresponde à sequência correta para preenchimento das lacunas:
B. Assinale a alternativa que corresponde à sequência correta para preenchimento das lacunas:

( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
A cinética química estuda a velocidade com que as reações químicas se processam.
Sobre cinética química julgue os itens a seguir.
I. Quanto mais alta a energia de ativação mais lenta será a reação.
II. Quanto menor a concentração dos reagentes, mais lenta será a reação.
III. Reações envolvendo reagentes exclusivamente no estado gasoso têm sua velocidade aumentada quando se diminui a pressão.
Está(ão) correta(s) a(s) sentença(s):
A reação: (CH3)3CCl + OH- → (CH3)3COH + Cl- foi estudada em solução aquosa e o mecanismo proposto é:

Para esse processo podemos afirmar que:
Uma certa reação química em fase gasosa é representada pela equação abaixo. Sabe-se que o reagente B e C não influi na velocidade da reação, mas o A quando elevado ao quadrado, altera a velocidade quadruplicada. Deste modo, assinale a alternativa que fornece a equação da velocidade CORRETA. 2A + 2 B → C
A realização de aulas experimentais de química é uma importante estratégia para o ensino de cinética química. No tocante ao estudo da relação existente entre a superfície de contato dos reagentes e a velocidade da reação química, o procedimento experimental que melhor expressa essa relação é:
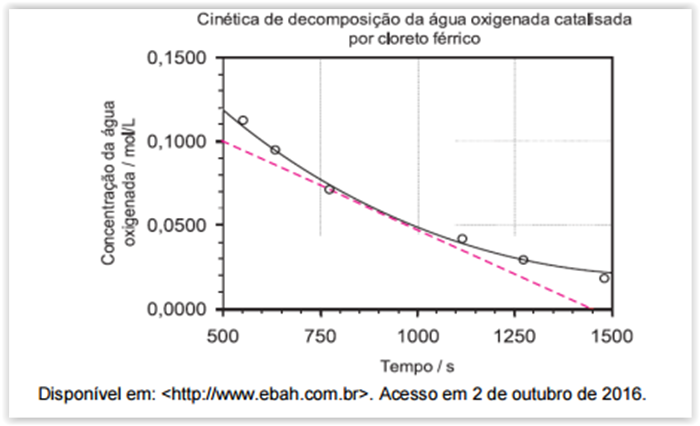
Considere o gráfico a seguir.
O gráfico expressa a cinética de decomposição da água oxigenada catalisada por
cloreto férrico. Por meio desse gráfico, verifica-se que a
Sabendo que o carbono grafite sofre combustão segundo a equação abaixo e que a velocidade de formação do dióxido de carbono é 4 mol/minuto.
C(grafite) + O2(g) CO2(g)
Assinale a alternativa que apresenta a velocidade de consumo do gás oxigênio.
A decomposição do NOCl pode ser descrita pela reação
elementar: 2NOCl(g) → 2NO(g)+Cl2(g).
Sendo a velocidade dessa reação dada em mol.L–1 . s–1, a sua
constante de velocidade será expressa em
A hematita (a–Fe2O3), além de ser utilizada para
obtenção do aço, também é utilizada como um catalisador
de processos químicos, como na síntese da amônia,
importante matéria–prima da indústria agroquímica.
MEDEIROS, M. A. F. Química Nova na Escola, São Paulo, v. 32, n. 3, ago. 2010 (adaptado).
O uso da hematita viabiliza economicamente a produção
da amônia, porque
Estudos cinéticos da reação 2NO + O2 → 2 NO2 mostraram que quando a concentração inicial de O2 é dobrada e a concentração de NO é mantida constante, a velocidade da reação dobra; quando a concentração inicial de NO é dobrada e a de O2 é mantida constante, a velocidade inicial quadruplica. Qual será o incremento da velocidade inicial da reação quando as concentrações iniciais de O2 e de NO forem triplicadas?
A respeito da constante de velocidade (k ) de uma reação
química, analise as afirmações a seguir.
I - Para processos de primeira ordem, a unidade de k é
mol/L s.
II - O valor de k é exatamente igual ao valor da inclina-
ção do gráfi co que relaciona variação da temperatura
em função do tempo.
III - O valor de k refl ete a efi ciência das colisões efetivas
que geram produtos numa reação química.
É correto APENAS o que se afirma em
Considere a seguinte reação de decomposição do pentóxido de dinitrogênio:

Nesse caso, a lei de velocidade da reação é dada por