Considere a equação da reação hipotética: X + Y + Z → W + T + Q São conhecidos os seguintes resultados do estudo cinético desta reação, obtidos nas mesmas condições experimentais:
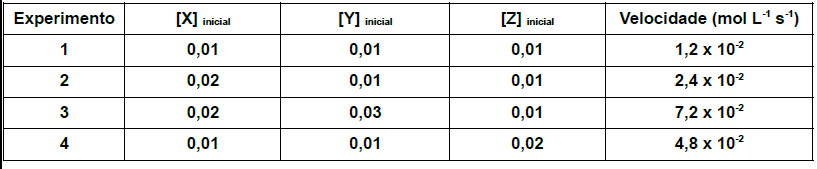
Considere [ ] = concentração mol L-1.
A partir das observações experimentais, conclui-se que a equação da velocidade para a reação é
A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que ocorrem em condições de
O peróxido de hidrogênio é um produto secundário do metabolismo celular e apresenta algumas funções úteis, mas, quando em excesso, é prejudicial, gerando radicais que são tóxicos para as células. Para se defender, o organismo vivo utiliza a enzima catalase, que decompõe H2O2 em H2O e O2. A energia de reação de decomposição, quando na presença e ausência da catalase, está mostrada no gráfico.
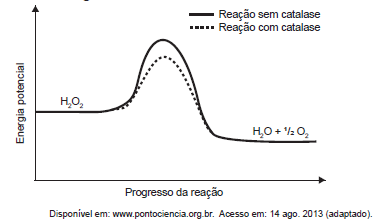
Na situação descrita, o organismo utiliza a catalase porque ela
A Química Verde é um ramo da química que prega o desenvolvimento de processos eficientes, que transformem a maior parte do reagente em produto, de forma mais rápida e seletiva, que utilizem poucos reagentes, que produzam somente o produto desejado, evitando a formação de coprodutos, e que utilizem solventes não agressivos ao meio ambiente. Assim, as indústrias contornariam problemas relacionados à poluição ambiental e ao desperdício de água e energia.
O perfil de um processo que segue todos os princípios desse ramo da química pode ser representado por:
Assinale a alternativa que contenha pelo menos um fator que não afeta a velocidade de uma reação no sentido direto.
Uma aproximação bastante difundida sobre a velocidade das reações químicas diz que a velocidade de uma reação realizada a 25°C duplica quando a temperatura se eleva em 10°C, para as mesmas concentrações de reagentes. Dessa forma, calcule a energia de ativação das reações que obedecem exatamente à afirmativa apresentada. Dados: R = 8,31 J.K-1 .mol-1 ; ln 2 = 0,7
Sobre a cinética enzimática, é correto afirmar que
O conhecimento da velocidade das reações químicas é de extrema importância para a produção industrial de uma série de produtos. Sobre o tem, assinale a alternativa correta.
Uma possibilidade de conversão gás-partícula é a reação direta entre gases resultando em finas partículas sólidas dispersas no ar. Um exemplo é a reação de neutralização de amônia com cloreto de hidrogênio em fase gasosa, que resulta em finas partículas de cloreto de amônio dispersas no ar, formando uma névoa. Essa reação é apresentada em um experimento clássico que ilustra a velocidade de difusão de gases e sua dependência com a massa molar. A reação de formação de NH4Cl (anel branco) ocorre na parte do tubo mais próxima à extremidade onde o HCl é introduzido. Dados: peso molar: H = 1 g/mol, N = 14 g/mol; Cl = 35,5 g/mol. Fonte: http://www.scielo.br/scielo.php?script=sci_arttext... 40422017000700824.

Assim, sendo a velocidade de difusão do cloreto de amônio igual a 27 km/min, pode-se determinar que a velocidade de difusão do HCl no sistema de Graham mostrado acima é
Na seguinte tabela, são apresentados os dados referentes a três experimentos de combustão do monóxido de carbono, conduzidos à temperatura de 300 K, em atmosfera padrão.
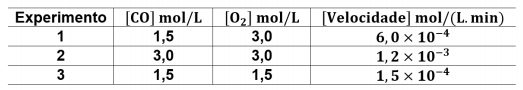
Com base nesses experimentos, a ordem global da reação é igual a
Considere uma reação hipotética com três reagentes (A, B e C) e um produto (D). A velocidade de formação de D foi monitorada em quantidades diferentes dos reagentes, conforme a tabela abaixo:
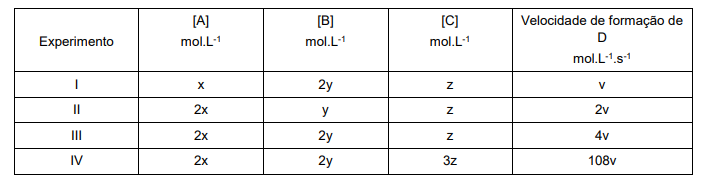
Determine a velocidade da reação em função de v se as concentrações de A, B e C, forem, respectivamente, igual a: 3x, 5y e 2z.
A alternativa que apresenta a equação de velocidade usada para calcular a concentração final [A] de uma reação de primeira ordem é
Dados: [A]0 = concentração inicial; k= constante de velocidade e t = tempo
O gás cloreto de carbonila (COCl2) é usado na síntese de muitos compostos orgânicos e pode ser obtido a partir da reação entre monóxido de carbono e gás cloro. Observe a tabela a seguir que demonstra as concentrações dos reagentes, em mol.L-1, e a velocidade da reação, em mol de produto.L-1.s-1, obtidas através de experimentos feitos a uma determinada temperatura:
Dado que log 2,8 = 0,45 e log 2 = 0,3, o valor da constante da velocidade desta reação é
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação seja alcançado mais rapidamente; quando alcançado, o equilíbrio estará mais deslocado para o sentido dos produtos.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item a seguir.
A velocidade de uma reação é proporcional às concentrações dos reagentes, com exceção das reações de ordem zero, em que as variações de concentração não produzem nenhum efeito.


