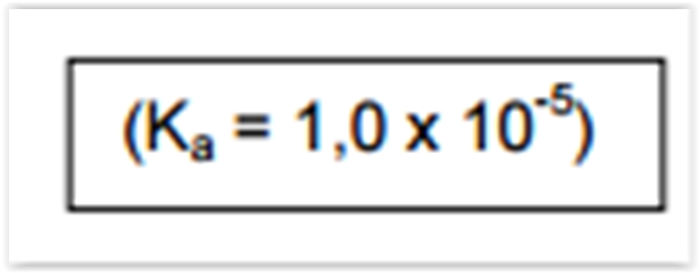O primeiro, segundo e terceiro termos de uma progressão aritmética são - x² - 6, x e 9 respectivamente, sendo x um número negativo. O quinto termo da progressão aritmética é igual a
A opção que NÃO apresenta o nome de um dispositivo apontador é
De acordo com a Constituição Federal, sobre o prazo de validade de um concurso público, é CORRETO afirmar:
Sobre o pagamento de diárias ao servidor, é CORRETO afirmar:
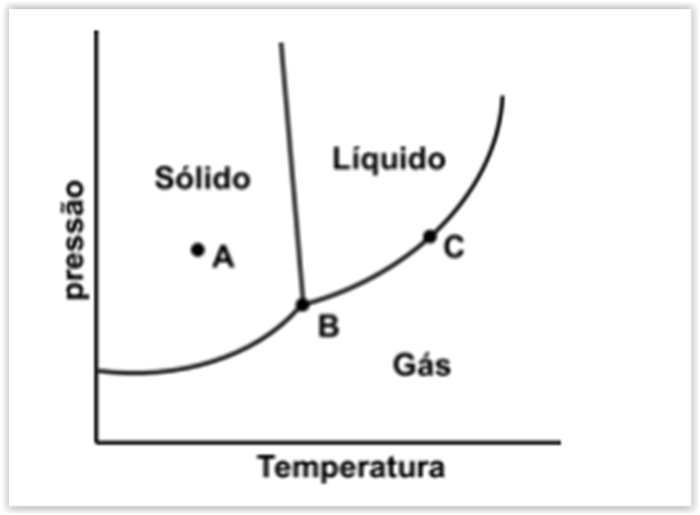
A Figura abaixo mostra um diagrama de fases de uma substância pura.
O número de fases que estão presentes em cada um dos pontos circulares identificados como A, B e C,
respectivamente, nessa figura, é
Considerando o sistema tampão formado pelo par ácido/base conjugada ácidopropanoico/íon propanoato
(CH3CH2COOH/CH3CH2COO-), calcule o valor de pH de 1,0 L de solução cuja
concentração de ácido propanoico é 0,0300 mol L-1
e de propanoato de sódio é 0,300 mol L-1. A resposta CORRETA é:
A célula eletroquímica representada pelo esquema da figura que segue, onde V é um
voltímetro e S é uma ponte salina que contém uma solução saturada de nitrato de potássio (KNO3), possui
um eletrodo de zinco imerso em uma solução de nitrato de zinco, Zn(NO3)2, e outro eletrodo de prata imerso
em uma solução de nitrato de prata, AgNO3, nas concentrações indicadas a 25ºC.
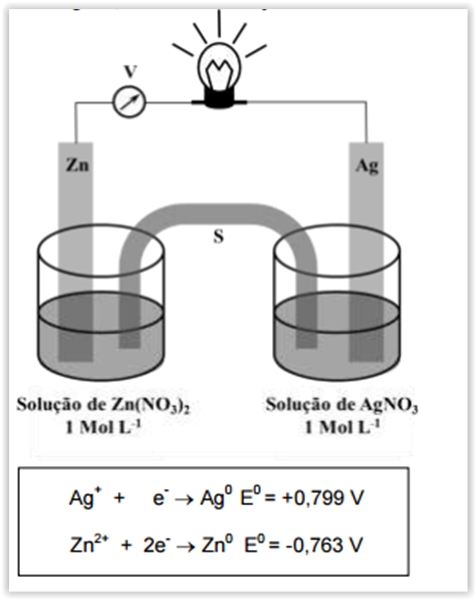
Considerando a célula eletroquímica e os potenciais-padrão de redução acima representados, é CORRETO
afirmar:
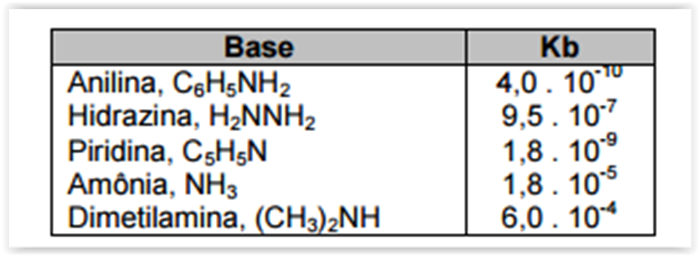
A tabela abaixo mostra os valores de constantes de dissociação, Kb, a 25 °C, para
diversas bases.
Analisando esses valores, é CORRETO afirmar:
Os instrumentos de medida empregados na Espectroscopia de Absorção Atômica (EAA) utilizam, como fonte de radiação, a lâmpada de catodo oco que emite luz IMAGEM
Uma gaveta contém 5 pares de meias brancas, 4 pares de meias azuis, 2 pares de meias vermelhas e 2 pares de meias pretas. O menor número de meias que devem ser retiradas da gaveta, sem olhar a cor, de modo que se tenha certeza de que sejam retiradas pelo menos duas meias de cores diferentes é igual a
A diferença entre dois números reais é igual a 30. O menor valor possível para o produto dos dois números é igual a
Existem várias formas de proteger um computador pessoal de invasores mal-intencionados. A opção que NÃO representa uma dessas formas é
A respeito da prestação de serviços gratuitos, a Lei nº. 8.112/1990 prevê
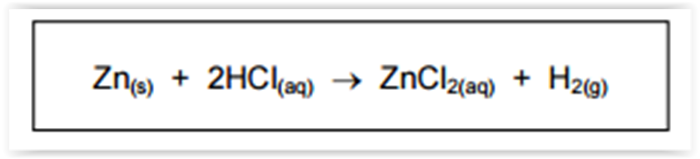
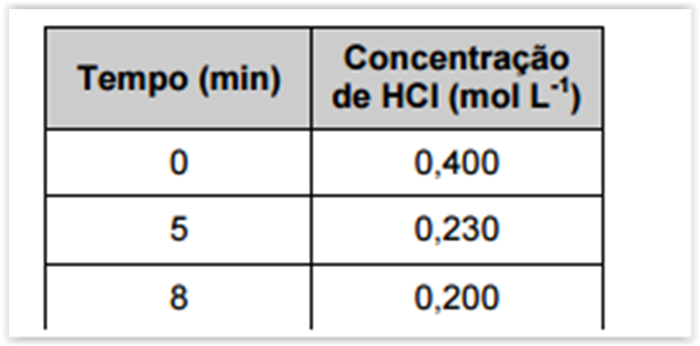
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1) no intervalo de 5 a
8 minutos é
Analise as reações abaixo.
I. SO2 + H2O2 → H2SO4
II. SO2 + H2O → H2SO3
III. SO2 + NH4OH → NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em