A lista abaixo descreve aleatoriamente as
etapas realizadas na preparação de uma solução
aquosa de HCl
A - Completa-se com água destilada até o traço
de referência do balão (menisco), com auxílio de
uma pipeta de Pasteur.
B - Adiciona-se o volume de HCl (calculado
previamente) com auxílio da pipeta graduada e
pêra de sucção, em capela de exaustão.
C - Identifica-se com nome do ácido, concentração,
data de preparo e responsável pela preparação.
D - Coloca-se em um balão volumétrico uma
alíquota de água destilada.
E - Transfere-se a solução preparada com auxílio
de um funil a um recipiente de vidro âmbar.
F - Tampa-se o balão, agita-se e inverte-se
por pelo menos 10 vezes para homogenizar o
sistema.
Com base nessas informações, assinale a
alternativa que apresenta a ordem CORRETA
das etapas no preparo dessa solução.
Em um processo químico, certas substâncias sofrem transformações em relação ao seu estado inicial (reagentes), dando origem ao aparecimento de novas substâncias (produtos), diferentes dos reagentes. Quando as substâncias reagem, às vezes, ocorrem fatos bastante visíveis que confirmam a ocorrência da reação e, dentre eles, podemos destacar: desprendimento de gás, emissão de luz, mudança de coloração e cheiro, formação de precipitados etc. Um exemplo de reação química muito comum em nosso cotidiano é a reação de combustão. Com base nisso, podemos afirmar que a alternativa que caracteriza um processo químico é:
Alguns elementos fogem à regra do octeto, ou seja, estabilizam-se sem que apresentem oito elétrons no último nível. São exemplos de substâncias que apresentam elementos com essas carcaterísticas:
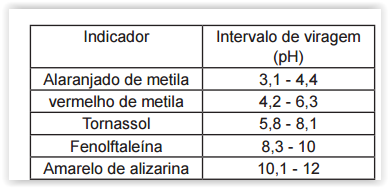
Deseja-se titular 50 mL de uma solução
aquosa de amoníaco (0,3 mol L-1), NH3 ( Kb = 1,8x 10-5), com HCl 0,3 mol L-1. Para isso, com base
nas informações da lista abaixo, qual indicador
deve ser usado para para essa titulação?
320mL de uma solução aquosa saturada de CaC2O4 necessita de 8,1mL de uma solução aquosa de KMnO4 a 0,0011 mol L-1 para completa oxidação do íon C2O4-2 em meio ácido. Com base nessa informação, é possível concluir que o Kps do CaC2O4 é:
Uma mistura sólida de massa igual a
1,1000g é composta por dois sais com fórmulas
genéricas, AX e BX, sendo os sais compostos
por cátions monovalentes e o mesmo ânion X-,
monovalente. O primeiro sal possui massa molar
60g/mol e o segundo possui massa molar 80g/
mol. A mistura é dissolvida em água isenta do
ânion X- e a seguir tratada com uma solução
de um nitrato de um metal M, em excesso.
Esse metal forma com o ânion X- um composto
insolúvel MX de massa molar igual a 120g/
mol. Após filtragem e secagem dos cristais de
MX, estes foram pesados em balança analítica
obtendo-se o valor de 1,8000g. Assinale a opção
que mostra as porcentagens em massa de cada
um dos sais na mistura sólida inicial.
Os elementos químicos mostram tendências em suas propriedades quando são listados em ordem crescente de seu número atômico formando grupos e períodos. Assinale a assertiva em que todos os elementos evidenciados pertencem ao grupo dos calcogênios:
Sabendo que a 25°C uma solução 0,025 mol L-1 de amônia apresenta 3,7% de ionização, pode-se dizer que depois que forem adicionados 0,0090 mol de NH4 Cl a 1 L dessa solução, a concentração do OH- é:
Quando PbCl2 sólido é adicionado à água pura à 25°C, o sal dissolve até a concentração de Pb2+ se igualar a 1,57 x 10-2 mol L-1. Após essa concentração, o sólido em excesso permanece insolúvel. Qual o Kps desse sal?
Sobre os erros em análises químicas, os
parâmetros estatísticos utilizados para as suas
avaliações e os conceitos de exatidão e precisão,
julgue os itens abaixo com V para VERDADEIRO
ou F para FALSO.
I - A exatidão descreve a reprodutibilidade das
medidas, em outras palavras, a proximidade
entre os resultados que foram obtidos através de
réplicas autênticas.
II - O desvio-padrão, a variância e o coeficiente
de variação são função de quanto os resultados
individuais diferem da média e são amplamente
empregados para descrever a precisão de um
conjunto de dados de réplicas.
III - Em geral, os erros grosseiros ocorrem de
forma ocasional, são grandes e levam a erros
absolutos negativos.
IV - Os erros aleatórios, ou indeterminados,
afetam a precisão dos resultados, enquanto os
erros sistemáticos, ou determinados, afetam a
exatidão dos resultados.
O alúmen de potássio é o principal
constituinte da pedra-ume ou pedra-hume, mas
não o único, pois a pedra-hume pode conter
outros alúmens. O alúmen de potássio ocorre
naturalmente, geralmente como incrustações em
rochas, em áreas de meteorização e oxidação
de sulfetos minerais e minerais de rolagem de
potássio. É comumente usado em purificação
de água, curtimento de couro, têxteis à prova de
fogo, produção de pão, entre outras aplicações.
Assinale a alternativa que apresenta a fórmula
molecular do alúmen de potássio:
0,15 mol de A é adicionado a um balão
volumétrico de 2,5L, mantido à 705K juntamente
com um catalisador, de modo que ocorre a
seguinte reação, A(g) + 2H2(g) = C(g). Hidrogênio é
introduzido no sistema até que a pressão total do
sistema atinja 8,5 atm e 0,08 mol de C seja formado.
Com base nessas informações, é possível de
dizer que os valores de Kc e Kp são (Dados: R =
0,082 atm L K-1 moL-1), respectivamente:
A uma solução tampão preparada pela mistura de 0,30 mol L-1 de ácido acético (CH3COOH) e 0,30 mol L-1 de acetato de sódio (CH3COON(A), adiciona-se 0,10 mol L-1 de hidróxido de sódio (NaOH). O pH dessa solução é (Dados: Ka do ácido acético = 1,8 x 10-5):
Um determinado sal de sódio possui
fórmula genérica NaX, sendo X um ânion
monovalente de massa molar igual a 65g/mol
e base conjugada de um ácido muito fraco de
fórmula genérica HX (o grau de ionização do
ácido é menor do que 0,5%, a 25°C). Assinale a
opção que mostra a massa desse sal que deve
ser adicionada a 200mL de uma solução do ácido
HX a 0,1mol/L, a fim de que o pH final da solução
seja numericamente igual ao pKa do ácido HX.
Dado: Massa molar do sódio = 23 g/mol
A grafite, também chamada chumbo negro ou plumbagina, tem múltiplas e importantes aplicações industriais, embora seja mais conhecida popularmente por sua utilização como mina do lápis. Quantos átomos de carbono são encontrados em uma massa de 1,02g de grafite? (Dado: número de Avogadro = 6,02x1023)