A eletrodeposição é um procedimento no qual a eletrólise é
utilizada para aplicar um revestimento fino ornamental ou
protetor de um metal sobre o outro, sendo uma técnica comum
para aumentar a durabilidade de um objeto de metal. Um dos
metais que pode ser usado como revestimento protetor é o
níquel, depositado a partir de uma solução de sulfato de
níquel(II).
A massa, em gramas, de níquel que deverá ser depositada
sobre uma chapa de aço a partir de uma corrente de 2,0 A por
30 minutos é, aproximadamente, de
Dados: Massa molar do Ni = 59 g.mol–1
1F = 96500C
O ibuprofeno é um analgésico e antitérmico que também pode ser utilizado em processos inflamatórios. A síntese desse composto, apresentada no final da década de 1990, utiliza três etapas: na primeira o 1−fenil−metil−propano reage em condições adequadas com anidrido etanóico formando o isômero acetilado na posição para. Nas etapas seguintes ocorre uma reação de hidrogenação em presença de catalisador, seguida de carboxilação formando o produto final que é um ácido carboxílico.
De acordo com as informações contidas no texto, o ibuprofeno é corretamente representada pela seguinte fórmula:
A L−dopa é um fármaco utilizado em alguns pacientes para o tratamento da doença de Parkinson. Uma etapa importante na síntese desse composto envolve a hidrogenação catalítica de uma enamida, produzindo o derivado da fenilalanina conforme a reação representada a seguir:
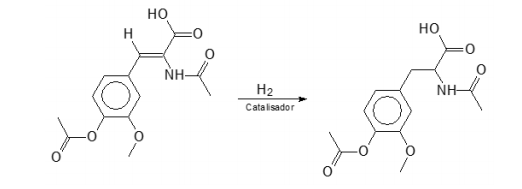
Os compostos orgânicos envolvidos nesta reação possuem, respectivamente, isômeros espaciais denominados
A estrutura geral de duas moléculas de polipropileno está representada na figura a seguir.
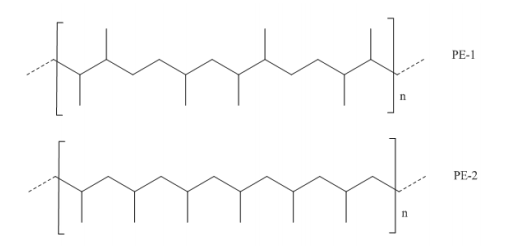
Sobre estas estruturas, assinale a afirmativa correta.
O carvão mineral é responsável por cerca de 8% de todo o consumo mundial de energia e de 39% de toda a energia elétrica gerada e, apesar dos graves impactos sobre o meio ambiente, o carvão continuará sendo, por muitas décadas, o principal insumo para a geração de energia elétrica, especialmente nos países em desenvolvimento.
A geração de energia a partir do carvão pode ser obtida através de um processo chamado de gaseificação de carão, onde o carvão reage com oxigênio molecular e água, sendo transformado em gás de síntese (CO+H2), que é queimado em seguida.
As equações químicas relativas ao processo de gaseificação do carvão estão representadas a seguir (considera−se o carvão mineral como carbono puro).

Com base nas informações fornecidas, a variação de entalpia, em kJ/mol do processo global é:
A combustão é uma reação entre uma substância (combustível)
e o oxigênio (O2) (comburente), com liberação de energia
levando à formação de gás carbônico e água. A falta de
oxigênio durante a combustão pode levar à formação de um
produto indesejável como a fuligem (C), que não tem oxigênio
na sua constituição.
A quantidade de calor liberada é menor nos casos de
combustão incompleta. Portanto, além de gerar compostos
nocivos à saúde humana, a combustão incompleta apresenta
uma grande desvantagem econômica, pois com a mesma
quantidade de combustível haverá menor quantidade de
energia gerada.
O calor liberado na combustão completa de metano é de
802 kJ.mol–1 e, nas mesmas condições de temperatura, o calor
liberado na queima incompleta desse composto, produzindo
fuligem é de 408,5 kJ.mol–1.
(Combustão e Energia disponível em
http://www.usp.br/qambiental/combustao_energia.html; Acesso 01/10/2013)
A massa de metano, queimada de maneira incompleta
produzindo fuligem, necessária para produzir a mesma
quantidade de calor que a queima completa de 8 kg de metano é
Dados: Massa molar do H=1 g.mol–1 C = 12g.mol–1
Uma forma de obter a energia necessária para o futuro é
encontrar maneiras efetivas de gerar eletricidade a partir das
reações químicas. Fontes de eletricidade portáteis, mas
eficientes, são necessárias para equipamentos pequenos, de
corações artificiais e computadores de bolso até automóveis
elétricos e habitações espaciais. Sendo assim, um dos ramos da
eletroquímica é o uso de reações químicas espontâneas para
produzir eletricidade.
(ATKINS, P. e JONES, L. Princípios de Química: questionando a vida moderna e o
meio ambiente. Porto Alegre: Bookman, 2001. p. 603. Adaptado)
Uma das formas de prever a espontaneidade de um processo
eletroquímico é por meio da análise dos potenciais−padrão de
redução.
Considere a tabela de potenciais a seguir.
A equação global que descreve o processo espontâneo, com
maior geração de energia, é dada por:
A viabilidade de qualquer forma de geração de energia não depende apenas dos custos de produção ou potencial energético, mas também do impacto ambiental causado pela sua obtenção. Uma possível alternativa para esse caso é o modelo de bateria de metal/ar.
A bateria Al/O2, por exemplo, pode atingir centenas de metros imerso na água do mar alimentando dispositivos e instrumentos durante vários meses.
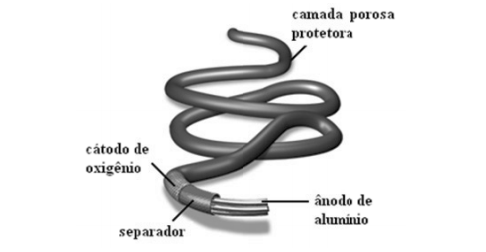
Sobre o funcionamento da bateria esquematizada na figura acima, assinale a afirmativa correta.
O professor preparou quatro experimentos para demonstrar
aos alunos os fatores que afetam as velocidades das reações.
Nestes experimentos o professor utilizou óxido de magnésio na
presença de quantidades iguais de água e do indicador
fenolftaleína.
As condições dos experimentos eram as seguintes:
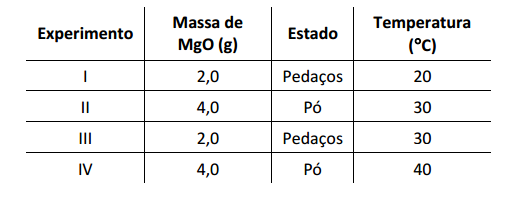
Os resultados permitiram avaliar as velocidades das reações através da mudança de coloração da solução.
Assinale a alternativa que indica a ordem de aparecimento da cor nos experimentos.
Alguns hidrocarbonetos aromáticos são essenciais para a síntese de um grande número de substâncias de importância econômica. Estes compostos são obtidos industrialmente por meio da Reforma Catalítica de determinadas frações de petróleo. Os hidrocarbonetos aromáticos são separados dos alifáticos por um processo de extração seletiva e, em seguida, purificados.
A tabela a seguir relaciona os hidrocarbonetos aromáticos produzidos através desse processo e as suas temperaturas de fusão e de ebulição.

Sobre a separação e purificação dos hidrocarbonetos aromáticos produzidos através da Reforma Catalítica, assinale a afirmativa correta.
O correto armazenamento dos reagentes utilizados em um laboratório de química é fundamental para garantir a segurança do professor e dos alunos. A organização dos reagentes deve sempre levar em conta o grau de risco representado por cada um deles, além da sua reatividade.
Um laboratório recém−inaugurado conta com os reagentes relacionados na lista a seguir, que devem ser organizados em armários diferentes.
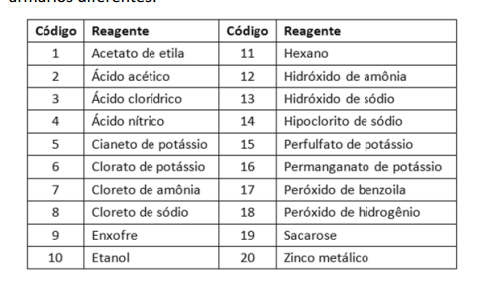
Assinale a alternativa que indica os códigos dos reagentes que deverão ser colocados em um mesmo armário.
Os equilíbrios químicos explicam grande número de fenômenos
naturais e têm papéis importantes em muitos processos
industriais. A constante de equilíbrio permite avaliar se a
reação é favorável aos produtos ou aos reagentes.
A tabela a seguir apresenta os valores das constantes de
equilíbrio em função das concentrações molares, calculadas a
500K, de alguns sistemas.

Em relação aos dados fornecidos na tabela, assinale a afirmativa correta. maior que o produto das concentrações dos reagentes.
“Uma alternativa à geração de energia através da combustão
do etanol é utilizá−lo como uma fonte de hidrogênio. O
hidrogênio produz energia e água em uma célula a combustível
e essa energia pode ser calculada através do ciclo de energia
global apresentado a seguir.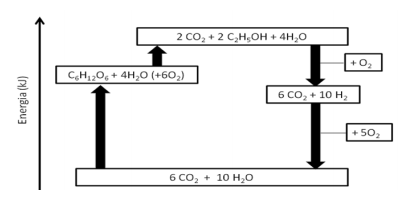
Neste ciclo o processo de fotossíntese gera glicose (C6H12O6) a
partir de CO2 e H2O com absorção de 2540 kJ para cada mol de
glicose produzido. Um mol de glicose é então convertido em 2
mol de etanol absorvendo 20 kJ. Na continuação do processo,
um mol de etanol produz H2 liberando 70 kJ por mol de etanol.”
(KOTZ, J.C., TREICHEL, P.M., WEOVER, G.C.. Química Geral e reações químicas
vol.1. São Paulo: Cengage Learning, 201p.251. Adaptado)
Considerando todo o processo descrito, a energia liberada na
conversão de hidrogênio em água, em kJ.mol–1, é igual a
Os avanços tecnológicos na eletrônica, no início do século XX, levaram à invenção do espectrômetro de massas, um aparelho capaz de determinar a massa de um átomo. Quando os cientistas usaram espectrômetros de massas descobriram que átomos de um mesmo elemento apresentavam massas diferentes. O espectro de massas de uma amostra de neônio (Z=10) perfeitamente puro está representado na figura a seguir.
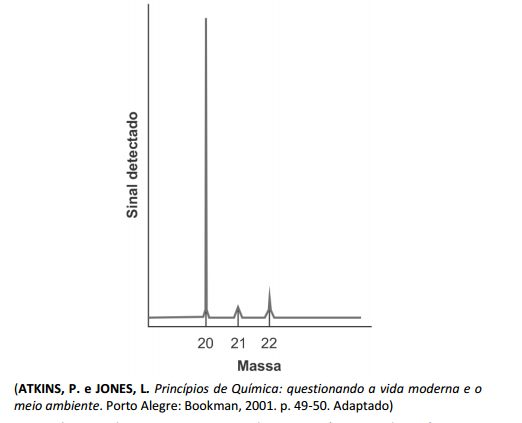
Assinale a alternativa que indica o número de nêutrons encontrado no núcleo do átomo que apresenta sinal de maior intensidade.
Diferentemente de outros elementos transurânicos, descobertos como resultado de um longo e cuidadoso planejamento (...) os elementos 99 e 100 foram descobertos “acidentalmente”, tendo sido gerados em uma explosão termonuclear em 1952.
A síntese desses novos elementos deu−se pela captura de nêutrons por parte do Urânio−238, seguida de emissão de partículas beta.
(FARIAS,R.F. Para gostar de ler a História da Química, 3° ed.Campinas, SP: Editora Átomo, 2008, p.73. Adaptado)
A emissão de partículas beta negativa nesse processo ocasionou

