Para o preparo de 250 mL de uma solução de NaCl 0,5 mol/L, sabendo-se que a massa molar do composto é igual a 58,44 g/mol, deve-se dissolver
Texto 1A04
A ninidrina (C9H6O4), utilizada em soluções para a revelação de impressões latentes sobre papel e outras superfícies porosas, reage com aminoácidos e outros compostos presentes nas impressões digitais, produzindo um composto de coloração arroxeada. A solução utilizada na perícia criminal, por meio de sua pulverização sobre superfícies, pode ser obtida a partir da dissolução de ninidrina em acetona.
Com relação aos cuidados na manipulação de substâncias perigosas e aos pictogramas apresentados a seguir, encontrados nos rótulos dos frascos que armazenam substâncias citadas no texto 1A04, assinale a opção correta.


pictograma I pictograma II
A eletronegatividade é uma propriedade de cada elemento ligada a força com que determinado elemento pode atrair elétrons para próximo de si. Essa propriedade afeta a distribuição eletrônica nas substâncias químicas.
Sobre a eletronegatividade e distribuição, eletrônicas assinale a alternativa correta.
Julgue os itens a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
As concentrações de soluções variam com a temperatura, já que estão sujeitas a dilatações e contrações à medida que a temperatura varia.
No que concerne ao estado físico da matéria, julgue os itens subsequentes.
O estado gasoso é aquele em que as forças intermoleculares estão mais fracas.

A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.

Considerando o assunto do texto precedente, julgue o item que se segue.
A transformação de metais citada no texto assemelha-se à atual transmutação dos elementos, como, por exemplo, aquela que ocorre na síntese dos elementos com número atômico maior que o do urânio na tabela periódica.
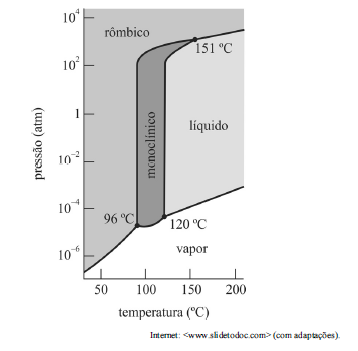
Com referência ao diagrama anterior, que apresenta as fases mais estáveis em pressões e temperaturas diferentes para o enxofre, julgue o item a seguir.
As três fases do enxofre podem coexistir nas temperaturas de 96 °C, 120 °C e 151 °C.
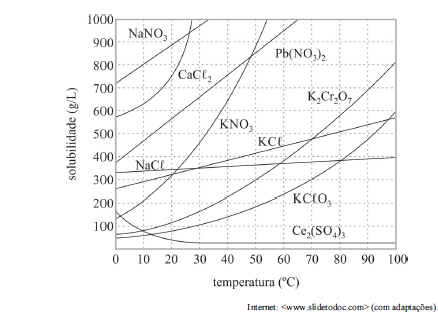
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
A 50 °C, uma solução de 100 mL que contém 80 g de KNO3 é classificada como insaturada.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação semimetais.
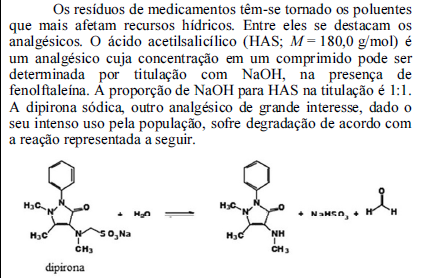
Com base nessas informações, julgue o próximo item.
Considerando-se que 500 mg de comprimido de HAS tenham sido dissolvidos em água e que a titulação desse ácido com NaOH 0,100 mol/L tenha gasto 25,00 mL, é correto concluir que a porcentagem de HAS no comprimido é superior a 91%.
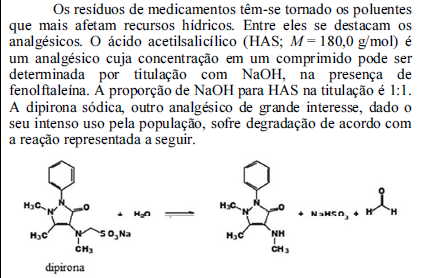
Com base nessas informações, julgue o próximo item.
Nessa reação, a dipirona atua como uma base de Brønsted-Lowry.
O ibuprofeno (M = 206 g/mol) é um analgésico e anti-inflamatório produzido a partir do ácido 3-fenilpropanoico. Em relação ao ibuprofeno e seu precursor, julgue o item a seguir.
A fórmula molecular do precursor do ibuprofeno é C9H10O2.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
A resolução de problemas é uma estratégia que contempla a estruturação de atividades de laboratório como investigações ou problemas práticos que o educando deve resolver. Essa estratégia só admite problemas fechados, em que os procedimentos e os recursos são dados pelo professor, cabendo ao aluno a tarefa de tirar suas conclusões.
No que se refere a conceitos básicos de técnicas, materiais e normas de segurança laboratoriais, julgue o item subsequente.
Em laboratórios de ensino, deve-se evitar utilizar certas substâncias químicas, tais como hidrazina, hidroxilamina e alguns peróxidos, que podem sofrer decomposição espontânea de forma explosiva, induzida por aquecimento, catalisadores ou um simples toque mecânico.

