Uma das etapas do tratamento das águas para consumo residencial consiste na adição sulfato de alumínio e hidróxido de cálcio, essa etapa é conhecida como floculação, pois forma “flocos” gelatinosos insolúveis em água que vão “agarrando” as partículas que estão sendo arrastadas pela água.
Abaixo é mostrada a reação entre essas duas substâncias.
AI2(SO4)3 + 3 Ca(OH)2 → 2 AI(OH)3 + 3 CaSO4
Como pode ser classificada essa reação?
Sobre as ligações químicas, analise as afirmativas.
I. A característica principal das ligações iônicas é a grande diferença de eletronegatividade entre os átomos. Um átomo deve ter baixa energia de ionização e o outro uma elevada afinidade eletrônica.
II. A atração eletrostática entre os íons na ligação iônica é a força mais significativa da estabilização da ligação.
III. A baixa energia de ionização necessária para uma ligação iônica é característica dos metais. A alta energia de afinidade eletrônica, que também é necessária para uma ligação iônica, é uma característica dos elementos químicos não metálicos, que necessitam de um, dois ou três elétrons para completar suas camadas de valência.
Está(ão) correta(s) a(s) afirmativa(s)
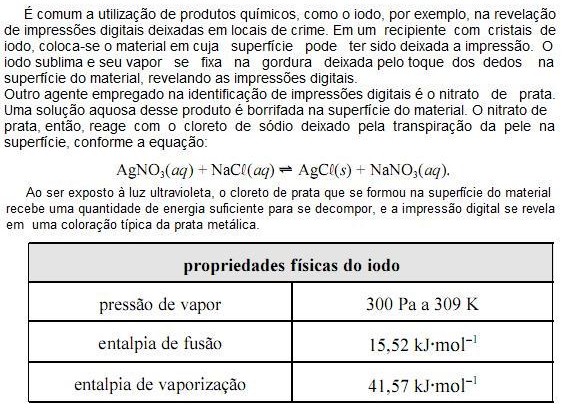
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
O volume molar do vapor de iodo a 309 K é superior a 8,0 m3 mol1
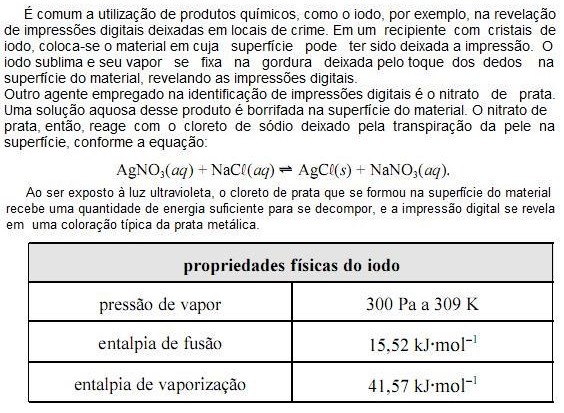
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
A partir das informações do texto, é correto concluir que a reação AgCL(s) ? Ag(s) + ½ CL2(g) é catalisada por luz ultravioleta.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Sabendo-se que o sódio e o cloro estão no mesmo período da Tabela Periódica e que o sódio pertence ao grupo 1 e o cloro, ao grupo 17, é correto concluir que a energia de ionização do cloro é superior à do sódio.