Considere que a relação entre a massa atômica (A) e o número atômico (Z) de um elemento X seja estabelecida pela expressão A = 2Z + 1 e que os últimos cinco elétrons do elemento X ocupem orbitais 2p. Nessa situação, é correto afirmar que X é isótono do átomo
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
O oxigênio (O) e o fósforo (P) pertencem ao mesmo grupo da tabela periódica.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
Segundo a classificação periódica dos elementos, o hidrogênio é considerado um metal alcalino.
Na tabela periódica da figura 1A03, o elemento químico representado por C é um
Ainda referente à tabela periódica da figura 1A03, o elemento químico representado por B é um
Acerca do diagrama de equilíbrio do aço-carbono, julgue os itens que se seguem.
No diagrama de equilíbrio do aço-carbono, em que são representadas as fases e transformações que ocorrem em ligas de ferro e carbono, o eixo vertical representa a composição em porcentagem de carbono na liga, enquanto o eixo horizontal representa a temperatura da liga.
Julgue o próximo item, relativo à natureza elétrica da matéria.
O primeiro modelo atômico que, baseado em método científico, explicou a natureza elétrica da matéria foi proposto por John Dalton, no século XIX.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
A reação de eletrólise da água é incompatível com o modelo atômico de Dalton, segundo o qual, em uma reação química, os átomos são alterados, pois as propriedades das substâncias são alteradas.
Na gasolina brasileira, um componente presente que merece destaque especial é o etanol. O Decreto n.º 10.940/2022 estabelece que a gasolina do tipo C deve conter 27% de etanol. O principal papel desse componente é atuar como antidetonante. Um ensaio simples para verificar o teor de etanol na gasolina comercial consiste em transferir 50 mL da amostra a ser avaliada para uma proveta de 100 mL, completando-se o volume com água destilada. Após agitação e repouso, a mistura contendo gasolina, etanol e água sofrerá separação.
Tendo como referência o ensaio acima descrito e considerando os usos da gasolina, julgue os itens que se seguem.
Uma das formas mais promissoras para a produção de combustíveis líquidos é a pirólise, também conhecida como craqueamento; ela pode acontecer na presença ou na ausência de catalisadores, que são responsáveis por alterar a cinética e o equilíbrio das reações químicas.
Texto 1A6
A fumaça contém uma variedade de compostos orgânicos, como o metano (CH4), o brometo de metila (CH3Br), o metanal (CH2O) e o dissulfeto de carbono (CS2). Metais e metaloides,como o césio (Cs), o chumbo (Pb), o arsênio (As) e o antimônio (Sb), além de estarem presentes na fumaça, muitas vezes são encontrados também em águas e superfícies contaminadas. A exposição crônica a essas substâncias aponta a necessidade de avaliação quanto à implementação de estratégias de segurança laboral que promovam a proteção dos bombeiros.
Barros et al. Biomonitoring of firefighting forces: a review on biomarkers
of exposure to health-relevant pollutants released from fires.
In: J. Toxicol. Environ. Health B Crit. Rev. 2023, n.º 3,
p. 127-171 (em livre tradução e com adaptações).
Com referência às moléculas apresentadas no texto 1A6, é correto afirmar que, em CH4, CH3Br, CH2O e CS2, o número de oxidação do átomo de carbono é, respectivamente,
Certo cientista, em seus estudos acerca do modelo atômico, elaborou um experimento que consiste em lançar partículas alfa em uma folha de platina para explicar por que a maior parte dessas partículas atravessava quase sem desvios a folha de platina, enquanto algumas sofriam desvios grandes.
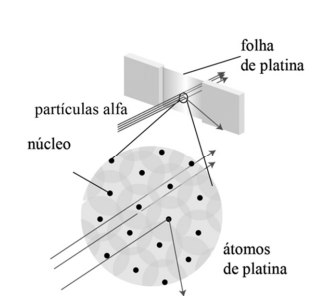
Internet: (com adaptações).
Em busca de respostas, esse cientista propôs o experimento e o modelo atômico da figura precedente e, ainda, inferiu que, quando uma dessas partículas com carga positiva atingia diretamente um dos núcleos de platina — muito pequeno, porém, muito pesado —, a partícula sofria um desvio muito grande, como se uma bola de tênis tivesse se chocado com uma bola de canhão parada.
Com base nessas informações, assinale a opção em que é apresentado o nome do cientista que propôs a referida explicação.
Figura 1A03
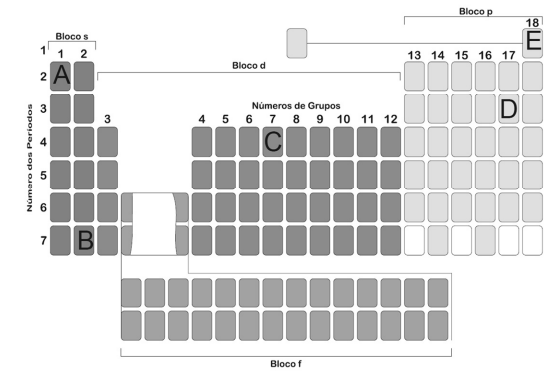
O elemento químico A, presente na tabela periódica representada na figura 1A03, é um
No que se refere à tabela periódica da figura 1A03, o elemento representado por E é um
Texto 1A6
A fumaça contém uma variedade de compostos orgânicos, como o metano (CH4), o brometo de metila (CH3Br), o metanal (CH2O) e o dissulfeto de carbono (CS2). Metais e metaloides,como o césio (Cs), o chumbo (Pb), o arsênio (As) e o antimônio (Sb), além de estarem presentes na fumaça, muitas vezes são encontrados também em águas e superfícies contaminadas. A exposição crônica a essas substâncias aponta a necessidade de avaliação quanto à implementação de estratégias de segurança laboral que promovam a proteção dos bombeiros.
Barros et al. Biomonitoring of firefighting forces: a review on biomarkers
of exposure to health-relevant pollutants released from fires.
In: J. Toxicol. Environ. Health B Crit. Rev. 2023, n.º 3,
p. 127-171 (em livre tradução e com adaptações).
Com base nas informações apresentadas no texto 1A6, sabendo que ZAs = 33, ZSb = 51, ZCs = 55 e ZPb = 82, que o Cs pertence ao
grupo 1A da tabela periódica, que o Pb pertence ao grupo 4A, que o As e o Sb pertencem ao grupo 5A, que o As está no 4.º período, que Sb está no 5.º período e que o Cs e o Pb estão, ambos, no 6.º período, é correto afirmar que a ordem crescente de energia de ionização é
O gás natural veicular (GNV) contido em um tanque de armazenamento ocupa um volume gasoso de 15 m3 e está submetido à pressão de 20 MPa às 6 h, quando a temperatura ambiente, em equilíbrio térmico com o gás, é de 10 °C.
Com relação a essa situação hipotética, julgue os itens seguintes, considerando que todos os gases se comportem idealmente,
que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se, às 18 h, a temperatura ambiente, em equilíbrio térmico com o gás, alcançar 30 °C, então, nessa nova situação, a pressão de gases no tanque será superior a 22 MPa.

