O calorímetro é um instrumento utilizado na medição de calor - também chamado de energia térmica - envolvido em uma mudança de estado de um sistema, que pode envolver uma mudança de fase, de temperatura, de pressão, de volume, de composição química ou qualquer outra propriedade associada com trocas de calor.
No calorímetro da figura abaixo, que opera em volume constante, 1000 moléculas de glicose foram queimadas.
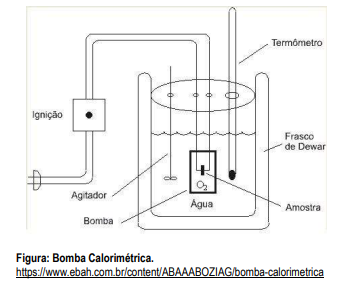
O calor do processo foi da ordem de 6397,5 KJ em temperatura igual a 25 °C. Dados: R = 8,314 JK-Mol- A variação de entalpia nesta reação foi igual a
O potencial químico de um gás perfeito é uma função linear do logaritmo da pressão. Porém, para gases reais, esta linearidade não se verifica. Que conceito termodinâmico é utilizado para compensar esse desvio da idealidade visando manter a linearidade e um formalismo semelhante?
O estudo sobre a espontaneidade de uma reação é um tema de extrema importância no estudo da química. Para essa análise, são consideradas as variáveis de estado entalpia, entropia e energia livre. Sendo assim, à pressão e temperatura constantes, um processo será espontâneo se apresentar
A concentração dos vapores oriundos de uma solução ideal contendo dois ou mais componentes voláteis pode ser diferente das concentrações dos componentes em solução. Assim, as pressões parciais dos vapores acima da solução serão dadas pela Lei de Raoult, e a pressão vapor total (Ptotal) será a soma das pressões parciais de cada componente. Considere como ideal uma mistura a 20 ºC contendo 1,0 mol de benzeno (Pº = 75 torr) e 2,0 mols de tolueno (Pº = 22 torr). Qual é a pressão de vapor total, em torr, sobre essa solução?
Em dias muito frios, é comum que encanamentos de água se rompam devido ao processo de congelamento. Esse fenômeno é atribuído ao fato de a água se expandir ao congelar. Quanto trabalho, em joules, uma amostra de 100 g de água realiza ao congelar em 0 ºC e estourar um cano de água que exerce uma pressão oposta de 1,070 atm?
(As densidades da água e do gelo, em 0 °C, são 1,00 e 0,92 g cm-3, respectivamente. w = - Pext ∆V; 1 L atm = 101,325 J)
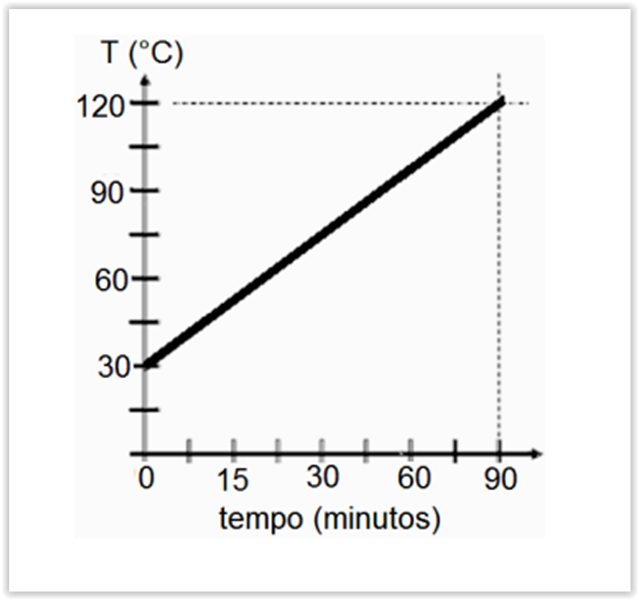
Três quartos de quilograma de uma substância desconhecida são aquecidos à taxa de 75 calorias por minuto, e a
variação de temperatura foi acompanhada conforme apresentado no gráfico abaixo. Com base nessas informações, o
calor específico da referida substância, em cal g-1 K-1
, é igual a:
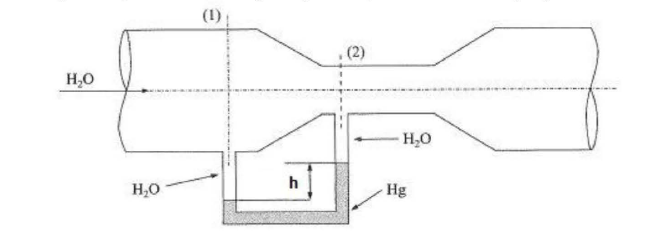
Nas indústrias químicas existe uma diversidade de processos que envolvem fluidos. Uma das variáveis de controle nesse caso é a vazão do fluido que escoa por certa tubulação horizontal. Para isso, pode-se usar um tubo Venturi para medir tal vazão. Assinale a alternativa CORRETA que contenha a expressão do cálculo da vazão de acordo com as respectivas variáveis do processo para um tubo circular. Considere a área da seção transversal (1) duas vezes maior que da seção (2), regime turbulento e despreze perdas de carga. Admita que: Q 1 é a vazão na seção (1); D1 é o diâmetro do tubo na seção (1); g é a aceleração da gravidade; h é a diferença de altura apontada no Venturi; p.H9 e p.H20 são as massas específicas do mercúrio e da água, respectivamente; e y é o peso específico do fluido que passa no tubo (1).
Sobre equilíbrio químico, considere as afirmativas a seguir e assinale a alternativa correta:
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores.
II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo.
III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade.
IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações.
V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta:
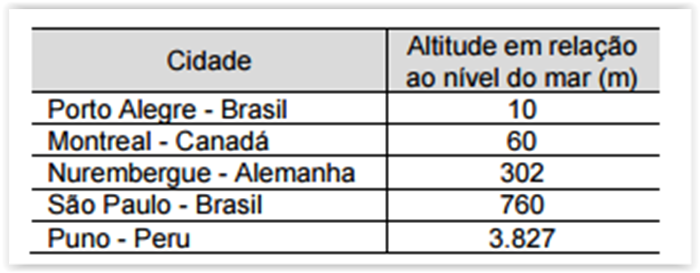
Considerar as localidades abaixo e suas respectivas
altitudes em relação ao nível do mar:
A menor temperatura de ebulição da água é observada
em:
No estudo de Termoquímica, o professor propôs uma experiência
para determinação do calor de combustão do álcool etílico
(etanol).
O procedimento experimental e as anotações de um grupo de
alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente
de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e
anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no
caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma
proveta e transferir para o erlenmeyer. Envolver as paredes
do erlenmeyer com jornal e prender com fita crepe. Colocar
em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor.
Valor anotado Ti = 25°C;
VI. acender a lamparina e aquecer a água do erlenmeyer,
durante 5 minutos. Após esse tempo, apagar a lamparina e
medir a temperatura da água (Tf) e anotar o valor. Valor
anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema
“álcool-lamparina”(mf) após a combustão. Valor anotado
mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1.°C–1 como
calor específico da água e a constante 0,2 cal.g–1.°C–1 como calor
específico do vidro, os alunos devem chegar a um valor para o
calor de combustão do álcool, em cal.g–1, de
As Leis da Termodinâmica explicam as variações de energia e a tendência de ocorrência dos processos de modo espontâneo, sendo essenciais para a compreensão da Química. Considerando, por exemplo, um processo que é exotérmico, em relação à espontaneidade, à variação de entropia (ΔS) e à temperatura, pode–se afirmar que:
A entalpia H, definida por H = U + PV, onde U é a energia interna, P é a pressão e V o volume do sistema, pode ser calculada em aquecimentos isobáricos a partir da relação dH = cP.dT, onde cP é o calor específico a pressão constante. É uma propriedade termodinâmica útil em cálculos de escoamento, por exemplo em um calorímetro de fluxo. Nesse equipamento, uma corrente líquida a uma temperatura conhecida é aquecida por uma resistência elétrica até vaporizar, sendo todo o processo a P constante. Em um determinado experimento, um líquido a 100 oC recebe 2200 J/g, gerando vapor saturado a 150 oC. Sabendo que o cP do líquido é de 2,6 J/goC, a entalpia de vaporização do líquido é:
Para a reação 2 N2O5(g) → 4 NO2(g) + O2(g), a 298K, é 3,38x10–5s–1
Considerando a cinética desta reação, assinale V a afirmativa
verdadeira e F para a falsa.
( ) Espera-se um decaimento exponencial do reagente, uma vez que a lei de velocidade da reação pode ser expressa por v = k [N2O5].
( ) A reação segue a cinética de segunda ordem.
( ) Um catalisador apropriado poderá aumentar a velocidade da reação uma vez que diminui a diferença de energia livre de Gibbs da reação.
As afirmativas são, respectivamente,
A Termodinâmica é a área da físico-química que estuda as
relações entre coordenadas como temperatura, volume e
pressão e o comportamento de substâncias puras e misturas em
processos específicos.
A Primeira Lei da Termodinâmica diz que a variação da energia
interna de um sistema pode ser expressa através da diferença
entre o calor trocado com o meio externo e o trabalho realizado
por ele durante uma determinada transformação. Potenciais
termodinâmicos permitem a avaliação da espontaneidade de
transformações físico-químicas.
A esse respeito, analise as afirmativas a seguir:
I. A variação da energia interna de um gás ideal em um
processo isotérmico é necessariamente nula.
II. É possível estabelecer a relação CvdT = -PdV para um gás
ideal em sistema isolado sofrendo uma transformação
adiabática, onde Cv é a capacidade calorífica a volume
constante, P é a pressão e dT e dV são variações infinitesimais
de temperatura e volume, respectivamente.
III. Um processo endotérmico espontâneo não ocorre com
aumento de entropia.
Assinale:
Certamente ocorrerá com diminuição de energia livre de Gibbs, ΔG, e portanto será espontânea em determinada temperatura T, uma transformação química que apresente]