No que se refere às ligações químicas e à geometria
molecular, julgue os itens subsecutivos.
No modelo de repulsão de pares eletrônicos da camada de valência, regiões de densidade eletrônica aumentada assumem posições tão separadas quanto possível e a geometria da molécula é identificada referindo-se às localizações dos átomos na estrutura resultante.
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Quando 22,20 g de cloreto de cálcio (de fórmula CaCl2 e massa molar igual a 111 g mol-1) são solubilizados em água até formar uma solução de volume igual a 1.000 mL, a concentração de íons cloreto na solução é igual a 0,4 mol L-1
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Em uma titulação ácido-base, um ácido é titulado com outro ácido com o objetivo de determinar a sua concentração. Nesse caso, o titulante é uma solução de concentração conhecida adicionada por meio de uma bureta.
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Titulação é a análise da composição por meio da medida da massa de um reagente necessária para reagir completamente com uma dada amostra desconhecida em solução.
O nitrogênio amoniacal é um parâmetro relevante para avaliação
da qualidade da água e pode ser determinado pelo método de
Kjeldahl.
Utilizando esse método, todo o nitrogênio de uma amostra de
um efluente foi adequadamente transformado em amônia que
foi recolhida em solução de ácido bórico. Posteriormente o
borato formado foi titulado, consumindo 24 mL de solução
padrão de ácido sulfúrico 0,5 mol.L-1.
A massa de nitrogênio (em mg) presente na amostra, é
aproximadamente igual a
Dados: Massa molares (g.mol-1) H3BO3 = 62, H2SO4 = 98, NH3 = 17 e N =14
Para demonstrar a digestão do amido pela saliva, o professor sugeriu um experimento com dois tubos de ensaio preparados com o seguinte conteúdo: Tubo 1: 2 mL de solução de amido e 2 mL de saliva. Tubo 2: 2 mL de solução de amido. Após 10 minutos, uma gota de iodo diluído foi adicionada a cada tubo. Depois de muita discussão, a turma chegou à conclusão de que o experimento estava incompleto e que, para melhorá-lo, seria necessário: I.substituir o tubo 2 por outro igual, porém com mais 2 mL de água. II.acrescentar um tubo 3, contendo 4 mL de água. III.acrescentar um tubo 4, com 2 mL de saliva mais 2 mL de água. Para resultados mais seguros seria necessário modificar o experimento conforme indicado
O conceito de solubilidade pode ser trabalhado em sala de aula
por meio de análise da curva de solubilidade apresentada sob a
forma de gráficos e/ou da realização de experimentos simples
que mostrem os fatores que alteram a solubilidade.
Após uma discussão sobre esse assunto em sala de aula foram
levantados pelos alunos alguns fatores que alteram a solubilidade
tais como: o solvente, o ponto de fusão do soluto, a temperatura
da solução, a pressão, as interações intermoleculares envolvidas.
O fator apresentado pelos alunos que deve ser rediscutido por
não influenciar na solubilidade das substâncias é
No preparo de uma solução, a metodologia geral afirma que o soluto deve ser dissolvido em um pouco de solvente e, a seguir, completado para o volume final em um(a )
Para o preparo em laboratório de uma solução 4% (massa/volume) de hidróxido de sódio a partir de 50 mL de uma solução 5 mol . L-1
dessa base, é necessário Dados: Massa molar (g.mor-1): Na = 23 0 = 16 H = 1
Um químico preparou, para neutralizar o rejeito de uma reação,
uma solução básica de hidróxido de sódio dissolvendo óxido de
sódio puro em água, em um balão volumétrico de 250 mL. Uma
alíquota de 25 mL desta solução foi transferida para outro balão
volumétrico e diluída com água até 500 mL. A solução resultante
apresentou pH igual a 13.
No preparo da solução básica, a massa de óxido de sódio (em
gramas) dissolvida foi igual a
Dados: Massa molar (g.mol–1): H = 1 O = 16 Na = 23
O uso indiscriminado de compostos orgânicos sintéticos
persistentes e acumulativos e as descargas de agentes
contaminantes têm provocado a degradação de alguns
ecossistemas aquáticos. Alguns desses compostos são
potencialmente cancerígenos e podem provocar efeitos
negativos na reprodução ou no desenvolvimento dos seres
humanos.
O Conselho Nacional do Meio Ambiente estabelece parâmetros
para enquadrar corpos d'água em classes. Cientistas avaliaram as
concentrações de endossulfan e dieldrin em três amostras
distintas de água e compararam com os parâmetros
apresentados na legislação.
Os dados deste estudo estão apresentados na tabela a seguir:
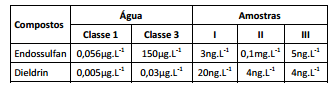
concentrações de endossulfan e dieldrin, são classificadas como
Sobre uma bancada, há dois frascos: um, com 30,0 mL
de solução aquosa de KOH 0,400 mol L-1 , e outro com
20,0 mL de solução aquosa de NaOH 0,650 mol L-1 . Essas
duas soluções foram transferidas quantitativamente
para um balão volumétrico de 250,00 mL e, em seguida,
acrescentou-se água destilada até o traço de referência.
A concentração de íons OH- , em mol L-1 , na solução resultante
é
O gráfico abaixo indica o grau de solubilidade de uma dada substância em 100 g de água a diferentes temperaturas.
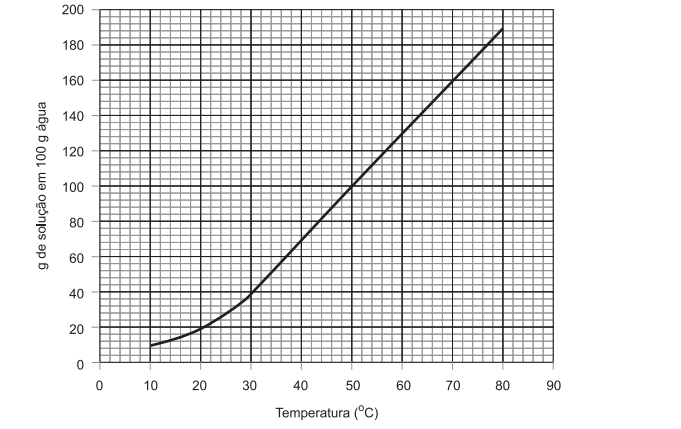
Em um recipiente de vidro, 240 g da substância são solubilizadas em 200 g de água na temperatura de 60 ºC.
A massa da substância, em g, que se deposita no recipiente de vidro quando a solução é resfriada a 50 ºC é
Um técnico dispõe de dois frascos. Um contendo solução de KOH 0,5 mol L-1 e outro contendo solução de NaOH 1,5 mol L-1 . Ele transferiu 40 mL da solução de KOH e 60 mL da solução de NaOH para um cilindro graduado de 1,0 L, acrescentou água destilada até o traço de referência (1,0 L) e, em seguida, homogeneizou bem a mistura.
Com esses procedimentos, ele obteve uma solução final cuja concentração de OH- em quantidade de matéria (mol L-1 ) é
Uma amostra de 15,0 g de bronze (liga metálica de cobre
e estanho) foi completamente dissolvida com ácido nítrico
concentrado, resultando em 1,00 L de solução aquosa.
Um volume de 0,500 L dessa solução foi misturado com
excesso de ferrocianeto de potássio, também em solução,
formando 17,0 g de um precipitado de ferrocianeto de cobre,
conforme a reação apresentada a seguir.
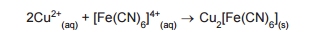
Sabendo-se que o Sn2+ não forma produto sólido com
o íon ferrocianeto, sendo apenas um íon espectador, a
massa de cobre, em g, presente na amostra de bronze é,
aproximadamente
Dados: M(Cu2 [Fe(CN)6 ] (s)) = 339 g mol-1 M(Cu) = 63,5 g mol-1

