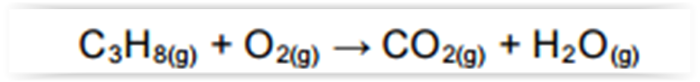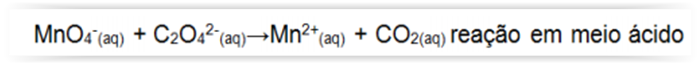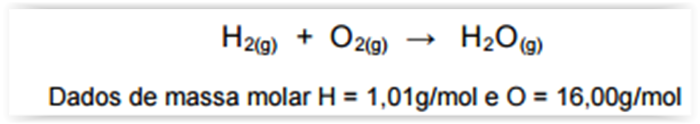A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
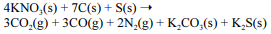
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão, na mesma proporção molar da reação apresentada, a queima de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto de potássio (K2S).
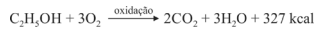
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Considere a combustão completa de dois mols de um dos compostos presentes na gasolina, o octano. Qual a quantidade mínima em mol de gás oxigênio necessária para esse processo?
Se a taxa de formação de gás nitrogênio no enchimento de um airbag é de 156,8 L (nas CNTP) a cada vigésimo de segundo, a taxa de consumo de azoteto de sódio, aproximadamente em mols por segundo, de acordo com a seguinte reação 2NaN3(s) → 2Na(s) + 3N2(g) é
Se colocados 100,0 g de Al(s) e 40,0 g de Cr2 O3 em alta temperatura, ocorrerá uma reação de oxidação de alumínio seguindo a reação: 2 Al(s) + Cr2 O3 (s) → Al2 O3 (s) + 2 Cr(l). Identifique qual será o reagente limitante desta reação e quantifique (em gramas) o excesso de reagente que permanece sem reagir. Dados: 1 mol de Al = 27 g Al, 1 mol de Cr2 O3 = 152,0 g Cr2 O3 .
Assinale a alternativa que possui ambas respostas corretas.
Considerando-se a reação abaixo, assinalar a
alternativa CORRETA:
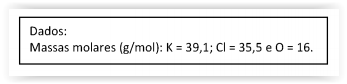
O hidróxido de magnésio (massa molar 58,33g/mol), conhecido como “leite de magnésia”, é frequentemente usado como antiácido para alívio de azia, má digestão e excesso de acidez no estômago. Considerando-se que uma colher (15mL) de leite de magnésia contenha 1.214mg de hidróxido de magnésio, qual a quantidade de matéria (mol) ingerida por um homem que administrou 5 doses (colheres) do medicamento ao longo do dia?
Considerando-se a reação de oxirredução a seguir, assinalar a alternativa CORRETA
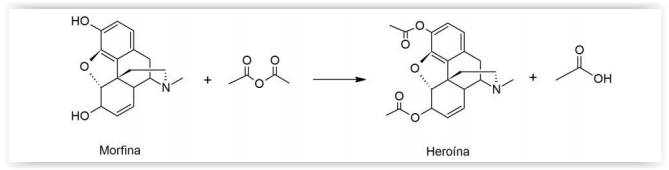
A morfina é um derivado do ópio, utilizado desde o século XIX como anestésico em campos de batalha e graves doenças
terminais. O derivado mais famoso desse alcaloide é a heroína, obtida pela acetilação da morfina com anidrido acético,
como ilustrado pela seguinte reação não balanceada:
De acordo com a reação acima, quantos mols de anidrido acético são necessários para acetilar totalmente 2 mols de
morfina?
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 .
Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.
Em estudo recente, pesquisadores da Embrapa mostraram
que a pecuária brasileira pode ser uma arma no combate ao
aquecimento global. De acordo com esse estudo, um boi
emite em média cerca de 0,4 toneladas de carbono, mas seu
consumo é de aproximadamente 2,5 toneladas. A 25 °C e 1
atm, qual é o volume de metano que deixa de ir (fixado
pelo animal) para atmosfera?
Considere que todo carbono é proveniente
de metano, que os gases são perfeitos e que
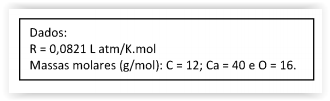
R = 0,0082 L atm K-1 mol-1.
A decomposição do KClO 3 geralmente é usada para produzir pequenas quantidades de O2 no laboratório a partir da seguinte reação balanceada: 2KClO3 (s) → 2KCl (s)+3 O2 (g). Quantos gramas de O2, aproximadamente, podem ser preparados a partir de 9,0 g de KClO3?
O carbonato de cálcio, CaCO
3(s), decompõe-se com aquecimento para produzir CaO(s) e CO2(g). Uma amostra de CaCO3 é decomposta e o dióxido de carbono é coletado num frasco de 300 mL. Depois de completada a decomposição, o gás tem pressão de 1,5 atm à temperatura de 27°C. Qual é a quantidade aproximada de matéria, em mol de CO2, produzida na decomposição?
Uma das etapas no processo comercial para converter amônia em ácido nítrico é a conversão de NH3 em NO, conforme a equação química não balanceada, a seguir:
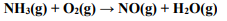
Em determinado experimento, misturou-se 1,7 g de NH 3 com 3,2 g de O2. Considerando que o rendimento da reação seja de 75%, a massa de NO(g) obtida, em gramas, será igual a
A reação a seguir é usada para produzir eletricidade
em uma célula a combustível. Com relação à reação,
assinalar a alternativa CORRETA: