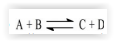Qual a diferença entre o tempo de meia vida de uma reação de primeira ordem e de segunda ordem?
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
De acordo com a teoria das colisões, um aumento na temperatura de reação ocasiona aumento no número total de colisões entre as espécies reagentes e na fração de colisões efetivas.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item a seguir.
Catalisador é a substância ou espécie que aumenta a velocidade de reação, não é consumida e fornece um mecanismo alternativo de baixa energia de ativação para a reação. Um catalisador é capaz de afetar a constante de equilíbrio da reação considerada, por modificar a velocidade da reação direta, aumentando o tempo requerido para o estabelecimento do equilíbrio.
Assinale a opção correta com relação a soluções, termoquímica e cinética química.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O efeito da adição do catalisador ácido é o de reduzir a energia de ativação da reação e, com isso, aumentar a fração de colisões efetivas.
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
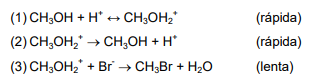
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo de metila, d[CH3Br]/dt, por meio da citada reação.
Se a taxa de formação de gás nitrogênio no enchimento de um airbag é de 156,8 L (nas CNTP) a cada vigésimo de segundo, a taxa de consumo de azoteto de sódio, aproximadamente em mols por segundo, de acordo com a seguinte reação 2NaN3(s) → 2Na(s) + 3N2(g) é
A velocidade é constante e não depende da concentração dos reagentes. Não existe uma relação direta entre os coeficientes e a ordem da reação. Essas são características cinéticas de reação de
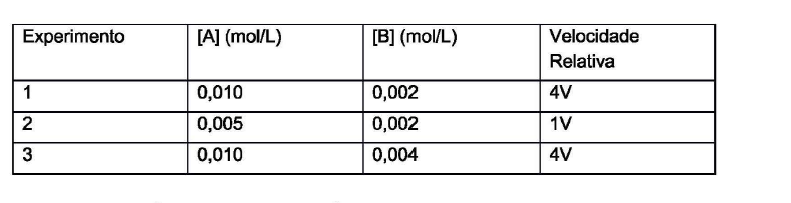
Uma reação química foi realizada a uma temperatura Te a uma pressão p. A reação é do tipo A+ B → C. Foram realizados três experimentos na qual se obteve uma velocidade de reação conforme indicado
A partir dessas informações podemos afirmar que:
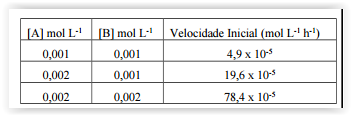
A equação
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3 h-1, é:
O diagrama abaixo representa a variação de energia durante a reação: A  B. Assinale a alternativa que corresponde à sequência correta para preenchimento das lacunas:
B. Assinale a alternativa que corresponde à sequência correta para preenchimento das lacunas:

( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
A cinética química estuda a velocidade com que as reações químicas se processam.
Sobre cinética química julgue os itens a seguir.
I. Quanto mais alta a energia de ativação mais lenta será a reação.
II. Quanto menor a concentração dos reagentes, mais lenta será a reação.
III. Reações envolvendo reagentes exclusivamente no estado gasoso têm sua velocidade aumentada quando se diminui a pressão.
Está(ão) correta(s) a(s) sentença(s):
A reação: (CH3)3CCl + OH- → (CH3)3COH + Cl- foi estudada em solução aquosa e o mecanismo proposto é:

Para esse processo podemos afirmar que:
Uma certa reação química em fase gasosa é representada pela equação abaixo. Sabe-se que o reagente B e C não influi na velocidade da reação, mas o A quando elevado ao quadrado, altera a velocidade quadruplicada. Deste modo, assinale a alternativa que fornece a equação da velocidade CORRETA. 2A + 2 B → C
A realização de aulas experimentais de química é uma importante estratégia para o ensino de cinética química. No tocante ao estudo da relação existente entre a superfície de contato dos reagentes e a velocidade da reação química, o procedimento experimental que melhor expressa essa relação é: