O processo de calagem consiste na diminuição da acidez do solo usando compostos inorgânicos, sendo o mais usado o calcário dolomítico, que é constituído de carbonato de cálcio (CaCO3) e carbonato de magnésio (MgCO3). Além de aumentarem o ph do solo, esses compostos são fontes de cálcio e magnésio, nutrientes importantes para os vegetais.
Os compostos contidos no calcário dolomítico elevam o ph do solo, pois
Laboratórios de química geram como subprodutos substâncias ou misturas que, quando não têm mais utilidade nesses locais, são consideradas resíduos químicos. Para o descarte na rede de esgoto, o resíduo deve ser neutro, livre de solventes inflamáveis e elementos tóxicos como Pb, Cr e Hg. Uma possibilidade é fazer uma mistura de dois resíduos para obter um
material que apresente as características necessárias para o descarte. Considere que um laboratório disponha de frascos de volumes iguais cheios dos resíduos, listados no quadro.
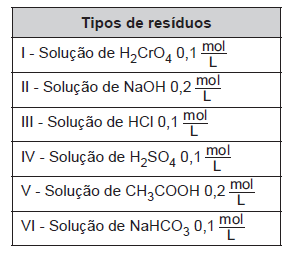
Qual combinação de resíduos poderá ser descartada na rede de esgotos?
Na busca por ouro, os garimpeiros se confundem facilmente entre o ouro verdadeiro e o chamado ouro de tolo, que tem em sua composição 90% de um minério chamado pirita (FeS2). Apesar do engano, a pirita não é descartada, pois é utilizada na produção do ácido sulfúrico, que ocorre com rendimento global de 90%, conforme as equações químicas apresentadas.
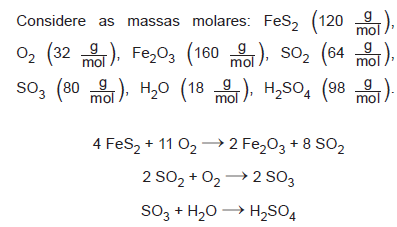
Qual é o valor mais próximo da massa de ácido sulfúrico, em quilograma, que será produzida a partir de 2,0 kg de ouro de tolo?
Dois amigos se encontram em um posto de gasolina para calibrar os pneus de suas bicicletas. Uma das bicicletas é de corrida (bicicleta A) e a outra, de passeio (bicicleta B). Os pneus de ambas as bicicletas têm as mesmas características, exceto que a largura dos pneus de A é menor que a largura dos pneus de B. Ao calibrarem os pneus das bicicletas A e B, respectivamente com pressões de calibração pA e pB, os amigos observam que o pneu da bicicleta A deforma, sob mesmos esforços, muito menos que o pneu da bicicleta B. Pode-se considerar que as massas de ar comprimido no pneu da bicicleta A, mA, e no pneu da bicicleta B, mB, são diretamente proporcionais aos seus volumes.
Comparando as pressões e massas de ar comprimido nos pneus das bicicletas, temos:
Algumas toneladas de medicamentos para uso humano e veterinário são produzidas por ano. Os fármacos são desenvolvidos para serem estáveis, mantendo suas propriedades químicas de forma a atender a um propósito terapêutico. Após o consumo de fármacos, parte de sua dosagem é excretada de forma inalterada, persistindo no meio ambiente. Em todo o mundo, antibióticos, hormônios, anestésicos, anti-inflamatórios, entre outros, são detectados em concentrações preocupantes no esgoto doméstico, em águas superficiais e de subsolo. Dessa forma, a ocorrência de fármacos residuais no meio ambiente pode apresentar efeitos adversos em organismos
aquáticos e terrestres.
BILA, D. M.; DEZOTTI, M. Fármacos no meio ambiente. Química Nova, v. 26, n. 4, ago. 2003 (adaptado).
Qual ação minimiza a permanência desses contaminantes nos recursos hídricos?
Uma das técnicas de reciclagem química do polímero PET [poli(tereftalato de etileno)] gera o tereftalato de metila e o etanodiol, conforme o esquema de reação, e ocorre por meio de uma reação de transesterificação.
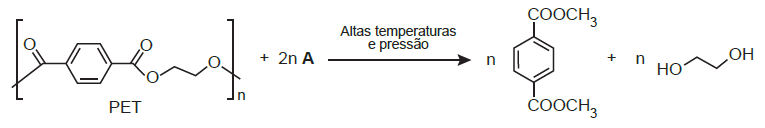
O composto A, representado no esquema de reação, é o
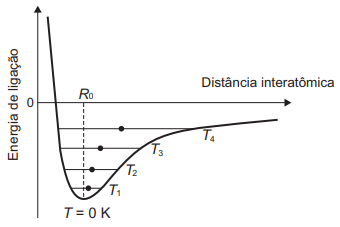
Alguns materiais sólidos são compostos por átomos que interagem entre si formando ligações que podem ser covalentes, iônicas ou metálicas. A figura apresenta a energia potencial de ligação em função da distância interatômica em um sólido cristalino. Analisando essa figura, observa-se que, na temperatura de zero kelvin, a distância de equilíbrio da ligação entre os átomos ( R0) corresponde ao valor mínimo de energia potencial. Acima dessa temperatura, a energia térmica fornecida aos átomos aumenta sua energia cinética e faz com que eles oscilem em torno de uma posição de equilíbrio média (círculos cheios), que é diferente para cada temperatura. A distância de ligação pode variar sobre toda a extensão das linhas horizontais, identificadas com o valor da temperatura, de T1 a T4 (temperaturas crescentes).
O deslocamento observado na distância média revela o fenômeno da
As células e os organismos precisam realizar trabalho para permanecerem vivos e se reproduzirem. A energia metabólica necessária para a realização desse trabalho é oriunda da oxidação de combustíveis, gerados no ciclo do carbono, por meio de processos capazes de interconverter diferentes formas da energia.
Nesse ciclo, a formação de combustíveis está vinculada à conversão de energia
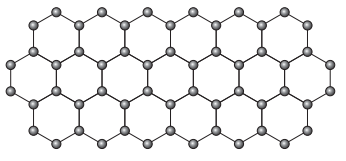
O grafeno é uma forma alotrópica do carbono constituído por uma folha planar (arranjo bidimensional) de átomos de carbono compactados e com a espessura de apenas um átomo. Sua estrutura é hexagonal, conforme a figura.
Nesse arranjo, os átomos de carbono possuem hibridação
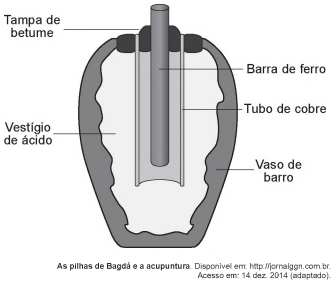
Em 1938 o arqueólogo alemão Wilhelm Konig, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como uma pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado. Considere os potenciais-padrão de redução: 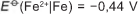
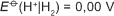
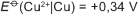
Nessa suposta pilha, qual dos componentes atuaria como cátodo?
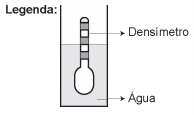
Usando um densímetro cuja menor divisão da escala, isto é, a diferença entre duas marcações consecutivas, é de 5,0 x 10 -2 g cm-3, um estudante realizou um teste de densidade: colocou este instrumento na água pura e observou que ele atingiu o repouso na posição mostrada.
Em dois outros recipientes A e B contendo 2 litros de água pura, em cada um, ele adicionou 100 g e 200 g de NaCl, respectivamente.
Quando o cloreto de sódio é adicionado à água pura ocorre sua dissociação formando os íons Na+ e Cl-. Considere que esses íons ocupam os espaços intermoleculares na solução.
Nestes recipientes, a posição de equilíbrio do densímetro está representada em:
Qual tipo de reação química a indústria alimentícia deve evitar para minimizar a obtenção desses subprodutos?
As indústrias de cerâmica utilizam argila para produzir artefatos como tijolos e telhas. Uma amostra de argila contém 45% em massa de sílica (SiO2) e 10% em massa de água (H2O). Durante a secagem por aquecimento em uma estufa, somente a umidade é removida.
Após o processo de secagem, o teor de sílica na argila seca será de
Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha.
A reação não balanceada que ocorre é:

Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
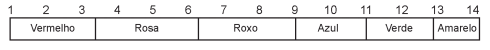
O suco de repolho-roxo pode ser utilizado como indicador ácido-base em diferentes soluções. Para isso, basta misturar um pouco desse suco à solução desejada e comparar a coloração final com a escala indicadora de pH, com valores de 1 a 14, mostrada a seguir.
Utilizando-se o indicador ácido-base e a escala para determinar o pH da saliva humana e do suco gástrico, têm-se, respectivamente, as cores