Existe no comércio um produto antimofo constituído por uma embalagem com tampa perfurada contendo cloreto de cálcio anidro, CaCl2. Uma vez aberto o lacre, essa substância absorve a umidade ambiente, transformando-se em cloreto de cálcio di-hidratado, CaCl2 ⋅2H2O.
Considere a massa molar da água igual a 18 g mol−1, e a massa molar do cloreto de cálcio anidro igual a 111 g mol−1.
Na hidratação da substância presente no antimofo, o ganho percentual, em massa, é mais próximo de
A presença de substâncias ricas em enxofre em áreas de mineração provoca preocupantes impactos ambientais. Um exemplo dessas substâncias é a pirita (FeS2), que, em contato com o oxigênio atmosférico, reage formando uma solução aquosa ferruginosa, conhecida como drenagem ácida de minas, segundo a equação química:

Em situações críticas, nas quais a concentração do ácido sulfúrico atinge 9,8 g/L, o pH alcança valores menores que 1,0. Uma forma de reduzir o impacto da drenagem ácida de minas é tratá-la com calcário (CaCO3). Considere que uma amostra comercial de calcário, com pureza igual a 50% em massa, foi disponibilizada para o tratamento.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000 (adaptado).
Qual é a massa de calcário, em gramas, necessária para neutralizar um litro de drenagem ácida de minas, em seu estado crítico, sabendo-se que as massas molares do CaCO3 e do H2SO4 são iguais a 100 g/mol e 98 g/mol, respectivamente?
O carvão é um combustível que tem várias substâncias em sua composição. Em razão disso, quando é representada sua queima com o oxigênio (massa molar 16 g mol−1), simplifica-se elaborando apenas a combustão completa do carbono (massa molar 12 g mol−1). De acordo com o conteúdo médio de carbono fixo, o carvão é classificado em vários tipos, com destaque para o antracito, que apresenta,
em média, 90% de carbono. Esse elevado conteúdo favorece energeticamente a combustão, no entanto, libera maior quantidade de gás que provoca efeito estufa.
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
A sacarase (ou invertase) é uma enzima que atua no intestino humano hidrolisando o dissacarídeo sacarose nos monossacarídeos glicose e frutose. Em um estudo cinético da reação de hidrólise da sacarose (C12H22O11), foram dissolvidos 171 g de sacarose em 500 mL de água. Observou-se que, a cada 100 minutos de reação, a concentração de sacarose foi reduzida à metade, qualquer que fosse o momento escolhido como tempo inicial. As massas molares dos elementos H, C e O são iguais a 1, 12 e 16 g mol−1, respectivamente.
Qual é a concentração de sacarose depois de 400 minutos do início da reação de hidrólise?
O crescimento da frota de veículos em circulação no mundo tem levado à busca e desenvolvimento de tecnologias que permitam minimizar emissões de poluentes atmosféricos. O uso de veículos elétricos é uma das propostas mais propagandeadas por serem de
emissão zero. Podemos comparar a emissão de carbono na forma de CO2 (massa molar igual a 44 g mol−1) para os dois tipos de carros (a combustão e elétrico). Considere que os veículos tradicionais a combustão, movidos a etanol (massa molar igual a 46 g mol−1), emitem uma média de 2,6 mol de CO2 por quilômetro rodado, e os elétricos emitem o equivalente a 0,45 mol de CO2 por quilômetro rodado (considerando as emissões na geração e transmissão da eletricidade). A reação de combustão do etanol pode ser representada pela equação química:
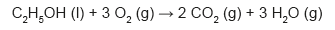
Foram analisadas as emissões de CO2 envolvidas em dois veículos, um movido a etanol e outro elétrico, em um mesmo trajeto de 1 000 km.
CHIARADIA, C. A. Estudo da viabilidade da implantação de frotas de veículos elétricos
e híbridos elétricos no atual cenário econômico, político, energético e ambiental brasileiro.
Guaratinguetá: Unesp, 2015 (adaptado).
A quantidade equivalente de etanol economizada, em quilograma, com o uso do veículo elétrico nesse trajeto, é mais próxima de
A combustão completa de combustíveis fósseis produz água e dióxido de carbono (CO2,massa molar 44 g mol−1). A União Europeia estabeleceu, desde 2012, limite de emissão veicular de 130 g de CO2 por quilômetro rodado (valor aplicável a uma média de veículos de um mesmo fabricante), tendo como penalidade multa, caso o fabricante ultrapasse a meta. A gasolina é uma mistura de hidrocarbonetos com cerca de oito carbonos em sua composição, incluindo isômeros do octano (C8H18). Considere que em uma cidade o consumo médio diário dos carros de um fabricante seja de 10 km L−1 de gasolina, formada apenas por octano (massa molar 114 g mol−1) e que sua densidade seja 0,70 kg L−1.
A diferença de emissão de CO2 dos carros desse fabricante em relação ao limite estabelecido na União Europeia é
Os esgotos domésticos são, em geral, fontes do íon tripolifosfato (P3O105−, de massa molar igual a 253 g mol−1), um possível constituinte dos detergentes. Esse íon reage com a água, como mostra a equação a seguir, e produz o íon fosfato (PO43−, de massa molar igual a 95 g mol−1), um contaminante que pode causar a morte de um corpo hídrico. Em um lago de 8 000 m3, todo o fósforo
presente é proveniente da liberação de esgoto que contém 0,085 mg L−1 de íon tripolifosfato, numa taxa de 16 m3 por dia. De acordo com a legislação brasileira, a concentração máxima de fosfato permitido para água de consumo humano é de 0,030 mg L−1.
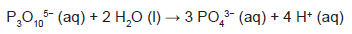
O número de dias necessário para que o lago alcance a concentração máxima de fósforo (na forma de íon fosfato) permitida para o consumo humano está mais próximo de
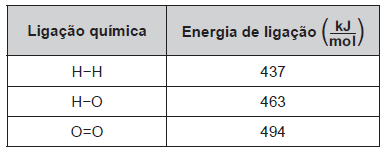
O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
![]()
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
Massas molares ![]()
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
O etanol é um combustível renovável obtido da cana-de-açúcar e é menos poluente do que os combustíveis fósseis, como a gasolina e o diesel. O etanol tem densidade ![]() massa molar
massa molar ![]() e calor de combustão aproximado de
e calor de combustão aproximado de ![]() Com o grande aumento da frota de veículos, tem sido incentivada a produção de carros bicombustíveis econômicos, que são capazes de render até
Com o grande aumento da frota de veículos, tem sido incentivada a produção de carros bicombustíveis econômicos, que são capazes de render até ![]() em rodovias, para diminuir a emissão de poluentes atmosféricos.
em rodovias, para diminuir a emissão de poluentes atmosféricos.
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
O vinagre é um produto alimentício resultante da fermentação do vinho que, de acordo com a legislação nacional, deve apresentar um teor mínimo de ácido acético (Ch3COOH) de 4% (v/v). Uma empresa está desenvolvendo um kit para que a inspeção sanitária seja capaz de determinar se alíquotas de 1 mL de amostras de vinagre estão de acordo com a legislação.
Esse kit é composto por uma ampola que contém uma solução aquosa de Ca(OH)2 0,1 ![]() e um indicador que faz com que a solução fique cor-de-rosa, se estiver básica, e incolor, se estiver neutra ou ácida. Considere a densidade do ácido acético igual a
e um indicador que faz com que a solução fique cor-de-rosa, se estiver básica, e incolor, se estiver neutra ou ácida. Considere a densidade do ácido acético igual a ![]() a massa molar do ácido acético igual a
a massa molar do ácido acético igual a ![]() e a massa molar do hidróxido de cálcio igual a
e a massa molar do hidróxido de cálcio igual a ![]()
Qual é o valor mais próximo para o volume de solução de Ca(Oh)2, em ml, que deve estar contido em cada ampola do kit para garantir a determinação da regularidade da amostra testada?
Na busca por ouro, os garimpeiros se confundem facilmente entre o ouro verdadeiro e o chamado ouro de tolo, que tem em sua composição 90% de um minério chamado pirita (FeS2). Apesar do engano, a pirita não é descartada, pois é utilizada na produção do ácido sulfúrico, que ocorre com rendimento global de 90%, conforme as equações químicas apresentadas.
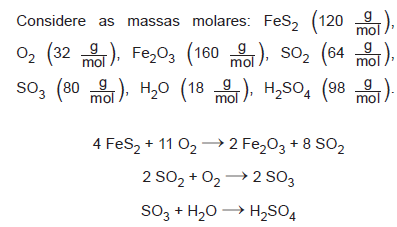
Qual é o valor mais próximo da massa de ácido sulfúrico, em quilograma, que será produzida a partir de 2,0 kg de ouro de tolo?

