As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas que atuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célula eletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve fornecer uma diferença de potencial mínima para promover a recarga. Quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencial padrão de redução dessas espécies:

Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço, a diferença de potencial mínima, em volt, que ele deve superar é de
Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.
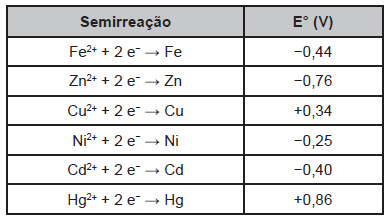
Dos metais citados, o que garantirá proteção ao tanque de aço é o
Para realizar o desentupimento de tubulações de esgotos residenciais, é utilizada uma mistura sólida comercial que contém hidróxido de sódio (NaOH) e outra espécie química pulverizada. Quando é adicionada água a essa mistura, ocorre uma reação que libera gás hidrogênio e energia na forma de calor, aumentando a eficiência do processo de desentupimento. Considere os potenciais padrão de redução (E0) da água e de outras espécies em meio básico, expressos no quadro.
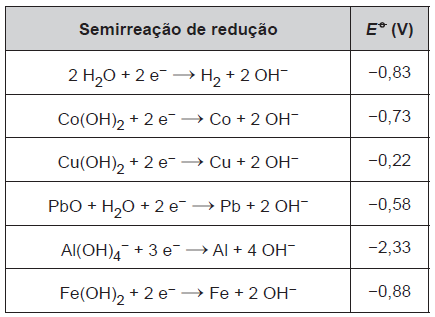
Qual é a outra espécie que está presente na composição da mistura sólida comercial para aumentar sua eficiência?
Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando a produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.

No funcionamento da bateria, a espécie química formada no ânodo é
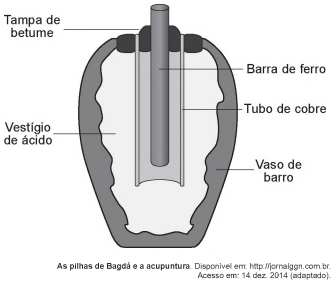
Em 1938 o arqueólogo alemão Wilhelm Konig, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como uma pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado. Considere os potenciais-padrão de redução: 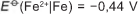
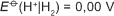
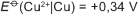
Nessa suposta pilha, qual dos componentes atuaria como cátodo?
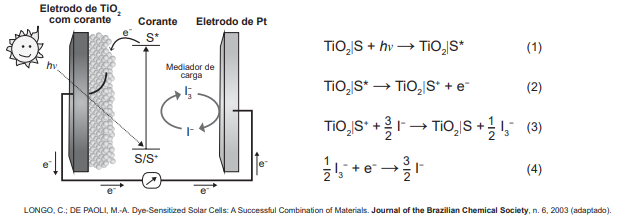
Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
A invenção do LED azul, que permite a geração de outras cores para compor a luz branca, permitiu a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes. Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento. Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas medições-padrão, suficiente para acender o LED azul?
A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
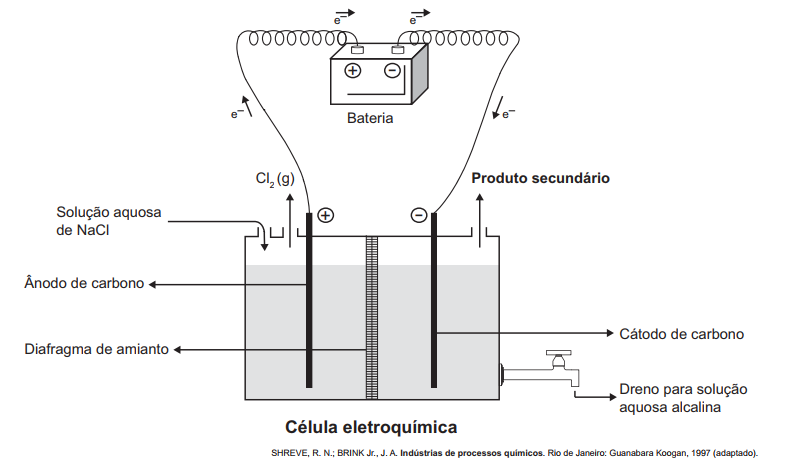
No processo eletrolítico ilustrado, o produto secundário obtido é o
A obtenção do alumínio dá-se a partir da
bauxita (Al2 O3 -3H2 O), que é purificada e eltrolisada
numa temperatura de 1 000 °C. Na célula eletrolítica, o
ânodo é formado por barras de grafita ou carvão, que são
consumidas no processo de eletrólise, com formação de
gás carbônico, e o cátodo é uma caixa de aço coberta
de grafita.
A etapa de obtenção do alumínio ocorre no

Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são:
Alimentos em conserva são frequentemente
armazenados em latas metálicas seladas, fabricadas com
um material chamado folha de flandres, que consiste de uma chapa de aço revestida por uma camada de
estanho, metal brilhante e de difícil oxidação. É comum
que a superfície interna seja ainda revestida por uma
camada de verniz à base de epóxi, embora também
existam latas sem esse revestimento, apresentando uma
camada de estanho mais espessa.
SANTANA, V. M. S. A leitura e a química das substâncias. Cadernos PDE. Ivaiporã:
Secretaria de Estado da Educação do Paraná (SEED); Universidade
Estadual de Londrina, 2010 (adaptado).
Comprar uma lata de conserva amassada no
supermercado é desaconselhável porque o amassado
pode
A calda bordalesa é uma alternativa empregada
no combate a doenças que afetam folhas de plantas.
Sua produção consiste na mistura de uma solução
aquosa de sulfato de cobre(II), CuSO4, com óxido de
cálcio, CaO, e sua aplicação só deve ser realizada se
estiver levemente básica. A avaliação rudimentar da
basicidade dessa solução é realizada pela adição de
três gotas sobre uma faca de ferro limpa. Após três
minutos, caso surja uma mancha avermelhada no
local da aplicação, afirma-se que a calda bordalesa
ainda não está com a basicidade necessária. O quadro
apresenta os valores de potenciais padrão de redução (Eo)
para algumas semirreações de redução.

A equação química que representa a reação de formação
da mancha avermelhada é:
A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)2-3. Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução em alguns íons metálicos.

Das espécies apresentadas a adequada para essa recuperação é
Os bafõmetros (etilõmetros) indicam a quantidade de álcool, C2H60 (etanol), presente no organismo de uma pessoa através do ar expirado por ela. Esses dispositivos utilizam células a combustível que funcionam de acordo com as reações químicas representadas:

Na reação global de funcionamento do bafõmetro, os reagentes e os produtos desse tipo de célula são
O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma lenda urbana, pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:
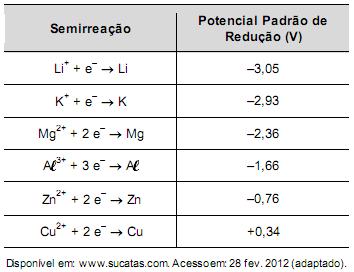
Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?