Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
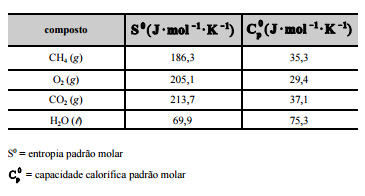
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
A combustão de um mol de CH4 (g), em condições padrão a
25 ºC, gera uma redução de mais de 1.000 kJ na energia livre
de Gibbs do sistema.
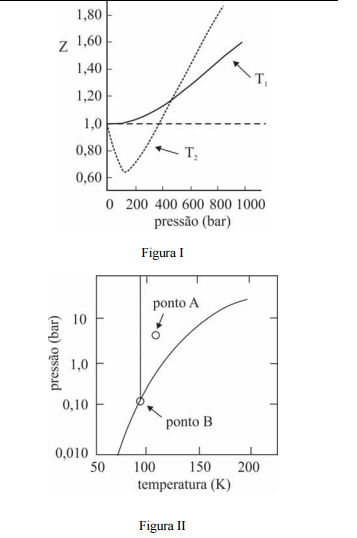
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z)
do CH4 (g) em função da pressão para duas temperaturas distintas
(T1 e T2), e a figura II representa o diagrama de fases desse mesmo
composto. A partir das figuras apresentadas, julgue os itens que se
seguem.
Na temperatura T2, o CH4 (g), a 200 bar de pressão, ocupará
um volume superior ao estimado pela equação dos gases ideais,
o que demonstra que as forças atrativas predominam sobre as
forças repulsivas.

Considerando que as reações de hidrogenação sejam exotérmicas,
que todos os gases envolvidos apresentem comportamento ideal e
que o produto da constante universal dos gases pela temperatura
absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se
seguem.
Sob determinada temperatura, a reação de hidrogenação do
C2H4 (g) liberará maior quantidade de calor se realizada a
volume constante, e não a pressão constante.
As bombas são máquinas que adicionam energia a uma corrente
fluida quando o escoamento é líquido ou pastoso. Com relação a
esses equipamentos, julgue os itens a seguir.
A perda de carga total é calculada pela diferença entre as
perdas de carga localizadas e distribuídas. Na operação de
bombeamento em dutos, essa perda refere–se à soma da energia
perdida pelo fluido, durante seu deslocamento, devido aos
efeitos de atrito do escoamento nos dutos, aos acessórios da
tubulação, às entradas e saídas e às mudanças de área.
Com referência ao processo de filtração e a parâmetros relacionados
a esse processo, julgue os itens que se seguem.
Na operação de filtração sob pressão constante, a vazão
durante a filtração reduz à medida que diminui a espessura da
torta. Esse tipo de filtração é adequado para precipitados
pouco compressíveis.
A respeito de análise granulométrica e peneiramento, julgue os
próximos itens.
Na análise granulométrica por sedimentação para determinação
do tamanho das partículas, faz–se uso de técnicas de análise de
tamanho que se baseiam em similaridades geométricas, como
o diâmetro de partícula, o qual, por sua vez, é determinado
pelos métodos em que se utiliza a lei de Stokes, aplicada em
regime turbulento.
No que se refere a mecanismos de troca de calor, julgue os itens a
seguir.
Os valores típicos para o coeficiente de troca de calor por
convecção forçada, em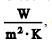 , estão na faixa de dezenas a
, estão na faixa de dezenas a
centenas para gases e de centenas a milhares para líquidos.
Com relação às misturas de vapor d'água com ar atmosférico em
determinada temperatura ambiente e volume fixo, julgue os itens
subsequentes.
Em uma carta psicrométrica, as linhas de umidade relativa
constante se afastam à medida que a temperatura de bulbo seco
aumenta.
Julgue os próximos itens, a respeito de evaporadores simples ou de
múltiplos efeitos.
Sistemas de evaporação de múltiplos efeitos empregam
dispositivos de reaquecimento do fluido quente, entre efeitos,
objetivando minimizar o fluxo de vapor total necessário nas
operações.
O cloro, o ácido nítrico e o ácido sulfúrico são compostos
inorgânicos bastante utilizados na indústria química para a
preparação de outros compostos inorgânicos e orgânicos
comercialmente importantes, como PVC (policloreto de vinila) e
fertilizantes, e no refino do petróleo, para remover impurezas da
gasolina e de outros óleos. Com referência aos processos de
produção dos compostos inorgânicos cloro, ácido nítrico e ácido
sulfúrico, julgue os itens que se seguem.
No processo de produção de ácido sulfúrico, utiliza–se como
matéria–prima para a obtenção do SO2 o enxofre, que sofre um
processo de combustão no qual são utilizados como agentes
comburentes o oxigênio puro ou o ar seco. A utilização de ar
seco proporciona ao meio reacional uma temperatura maior
que a obtida ao se utilizar oxigênio puro.
O cloro, o ácido nítrico e o ácido sulfúrico são compostos
inorgânicos bastante utilizados na indústria química para a
preparação de outros compostos inorgânicos e orgânicos
comercialmente importantes, como PVC (policloreto de vinila) e
fertilizantes, e no refino do petróleo, para remover impurezas da
gasolina e de outros óleos. Com referência aos processos de
produção dos compostos inorgânicos cloro, ácido nítrico e ácido
sulfúrico, julgue os itens que se seguem.
A produção massiva do ácido nítrico ocorre por meio do
processo Ostwald, em que são utilizados amônia anidra, ar e
água como matérias–primas e uma tela de platina–ródio como
catalisador.
Caldeiras e trocadores de calor são equipamentos de transferência de energia térmica através de mecanismos de condução, convecção e irradiação. Em relação a esses equipamentos e mecanismos, é correto afirmar:
Com relação a aplicação de métodos potenciométricos de análise e a calibração de seus instrumentos, identifique como verdadeiras ( V) ou falsas (F ) as seguintes afirmativas: ( ) A adição de pequenas quantidades de água às soluções-tampão de pH 4 eleva ligeiramente o seu pH. ( ) A equação de Nernst prediz a extensão da variação da força eletromotriz de uma célula eletroquímica quando as concentrações dos reagentes ou produtos são variadas. ( ) A adição de um sal inerte a uma solução contida em uma célula eletroquímica não altera o seu valor de força eletromotriz. ( ) A calibração de um eletrodo íon-seletivo se faz necessária porque, dentre outras incertezas, o potencial de junçãolíquida não pode ser calculado ou medido experimentalmente. Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
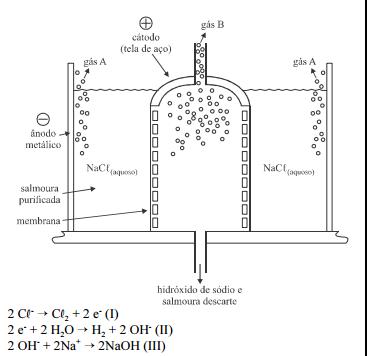
A produção de hidróxido de sódio e cloro gasoso é um dos mais
importantes processos da indústria química. Em geral, utiliza–se
uma célula eletrolítica para decompor salmoura purificada (solução
de NaCR) em hidróxido de sódio, cloro e hidrogênio gasosos. As
câmaras do cátodo e do ânodo devem ser separadas por um
diafragma, para serem evitadas a difusão de certos íons por meio
dos compartimentos e a formação de subprodutos. Acima são
apresentados o diagrama esquemático da célula eletrolítica e as
reações principais que ocorrem no cátodo e no ânodo.
Com base nessas informações, julgue os itens a seguir, referentes a
eletroquímica.
A figura indica que o diafragma inibe a migração de íons OHdo
compartimento catódico para o anódico. Se isso não
ocorresse, haveria formação de hipoclorito, em vez de cloro
gasoso.
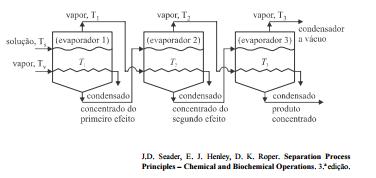
Um produto inorgânico pode ser obtido industrialmente a partir de
uma solução aquosa aumentando–se, por meio do uso de
evaporadores, a concentração da solução até próximo à saturação.
Considerando esse assunto e a figura acima, que representa o
diagrama esquemático de um sistema de evaporadores de triplo
efeito com alimentação direta, julgue os itens subsequentes.
A quantidade de água evaporada é maior no evaporador 1.