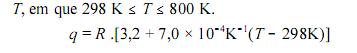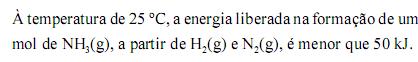Qual é a massa de CO2, em toneladas, que deixa de ser
liberada na atmosfera, para cada 100 g de pastilhas de
urânio enriquecido utilizadas em substituição ao carvão
como fonte de energia?
O aproveitamento de residuos florestais vem se
tornando cada dia mais atrativo, pois eles são uma fonte
renovavel de energia. A figura representa a queima de um bio-oleo extraido do residuo de madeira sendo Δ H1
a variação de entalpia devido à queima de 1 g desse
bio-óleo, resultando em gás carbônico e água líquida, e
Δ H2 a variação de entalpia envolvida na conversão de 1 g
de água no estado gasoso para o estado líquido.
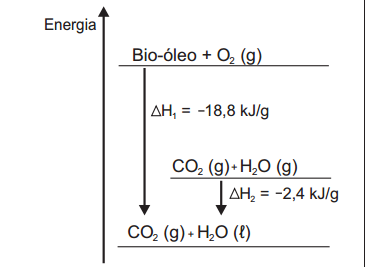
A variação de entalpia, em kJ, para a queima de 5 g desse
bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:
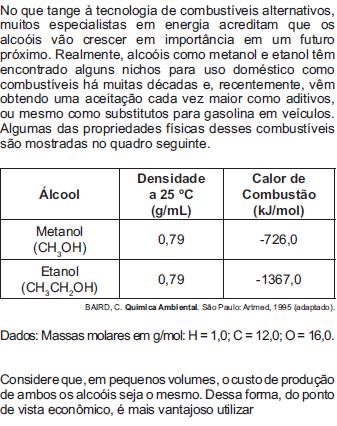
A escolha de uma determinada substãncia para ser utilizada como combustível passa pela análise da poluição que ela causa ao ambiente e pela quantidade de energia liberada em sua combustão completa. O quadro apresenta a entalpia de combustão de algumas substãncias. As massas molares dos elementos H, C e O são, respectivamente, iguais a 1 g/mol, 12 g/mol e 16 g/mol.

Levando-se em conta somente o aspecto energético, a substãncia mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o
Uma das possíveis alternativas para a substituição da gasolina como combustível de automóveis é a utilização do gás hidrogênio, que, ao reagir
com o gás oxigênio, em condições adequadas, libera energia necessária para o funcionamento do motor, conforme a equação química a seguir:
2 H2 (g) + 02 (g) —> 2 H2O (g) + energia
Esta opção para a substituição da gasolina contribuiria para que a condição do meio ambiente seja melhorada,
visto que O
Em uma reação química a variação da entalpia é sempre a mesma, quer ela ocorra em uma única etapa ou em várias. A variação da entalpia depende somente dos estados inicial e final. Esse conceito é conhecido como a lei de:
Uma amostra de 0,100 g de propano foi queimada com excesso de oxigênio em um calorímetro calibrado de pressão constante, cuja capacidade calorífera é de 520 J.C–1. Nessa experiência a temperatura do calorímetro aumentou 9,62ºC. Utilizando os dados apresentados, a entalpia de combustão do propano em kJ.mol–1 é aproximadamente: Dados: Massa molar (g.mol–1): H = 1 C = 12
A queima de um palito de fósforo é uma reação de combustão que pode ser representada, simplificadamente, por:
Madeira + oxigênio → gás carbônico + água + calor
Nessa reação ocorre liberação de energia na forma de calor. Uma pergunta interessante sobre a reação é: De onde veio essa energia? A energia liberada estava contida nos reagentes e, quando eles se transformaram nos produtos, essa energia foi liberada.
Isso permite concluir que cada substância deve apresentar certo conteúdo de energia, que é denominada:
A reciclagem exerce impacto considerável sobre a eficiência energética. Embora restaurar materiais que foram descartados também consuma energia, é possível que essa energia seja substancialmente menor. O gráfico seguinte indica a quantidade de energia necessária para a produção de materiais primários e reciclados. A maioria dos metais ocorre na crosta terrestre como óxidos que devem ser reduzidos para recuperar o metal elementar, o que consome grande quantidade de energia. As entalpias-padrão de formação dos óxidos de alumínio e ferro são, respectivamente: -1 675,7 kJ/mol e -824,2 kJ/mol.
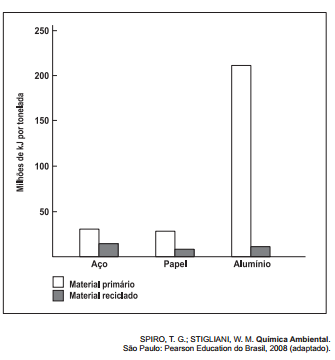
A energia gasta na obtenção do alumínio a partir do seu material primário é maior do que a do aço, porque o alumínio

A geometria planar da molécula de amônia é responsável pelo seu elevado calor de vaporização.
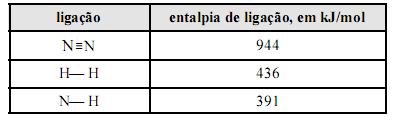



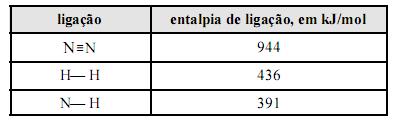
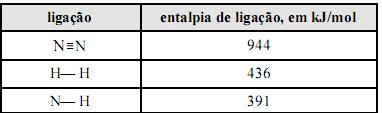
Considere que a amônia (NH3), largamente empregada como gás refrigerante, em razão de seu elevado calor de vaporização, pode ser obtida a partir da reação 3H2(g) + N2(g) 2NH3(g). Considere, ainda, a tabela acima, em que constam as entalpias de ligação, a 25 ºC, das ligações rompidas ou formadas durante a reação em questão. Com base no conjunto de informações apresentado, julgue os itens que se seguem.
A reação de formação da amônia, a partir de H2(g) e N2(g), libera mais calor quando processada a volume constante, comparando-se quando processada a pressão constante.
Um dos problemas dos combustíveis que contêm carbono é que sua queima produz dióxido de carbono. Portanto, uma característica importante, ao se escolher um combustível, é analisar seu calor de combustão (ΔHc0) definido como a energia liberada na queima completa de um molde combustível no estado padrão. O quadro seguinte relaciona algumas substâncias que contêm carbono e seu ΔHc0.
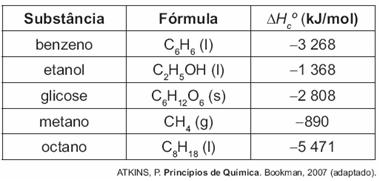
Neste contexto, qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida?

Considerando as informações acima e que todos os gases envolvidos sejam ideais, julgue os itens a seguir.
Na equação abaixo, se expressa, corretamente, a quantidade de calor (q) necessária para elevar, a pressão constante, a temperatura de um mol de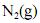 de 298 K até uma temperatura
de 298 K até uma temperatura