As substâncias que, quando colocadas em água, liberam, exclusivamente, ânions OH– , classificam‐se como bases de Arrhenius. Assinale a alternativa que contém apenas bases de Arrenhius.
Um método clássico da química analítica de medir o teor de água oxigenada é a reação da água oxigenada com íon permanganato, que é reduzido a Mn+2, em meio ácido, de acordo com a equação a seguir (não balanceada).
KMnO4(aq) + H2O2(aq) + H+ (aq) → Mn2+ (aq) + H2O(l) + O2(g)
Um analista recebeu em um Erlenmeyer um volume de 10 mL de uma amostra de água oxigenada e acrescentou 100 mL de água destilada. A análise foi feita utilizando 15,3 mL de uma solução padrão de permanganato de potássio padrão 0,1103 mol/L. (Considere as seguintes massas moleculares (g/mol): Mn = 55; H = 1; O = 16; K = 39.)
O teor de H2O2 na amostra anterior, expresso em g% (m/V), e o de mol/L são, respectivamente,
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Supondo-se que tivessem sido injetados no condenado 50 mL de uma solução letal com concentração de KCl igual a 1,6 molL1 , é correto afirmar que a massa de sal injetada equivaleria a 6,0 g.
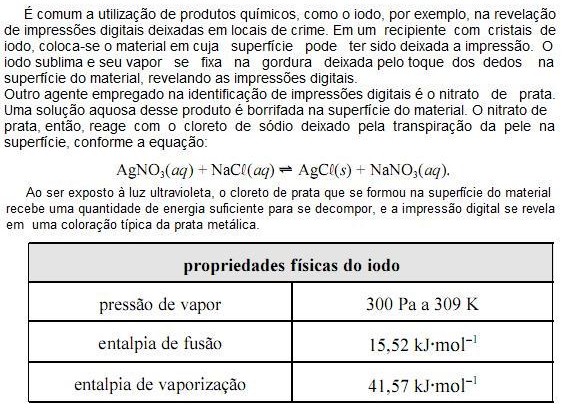
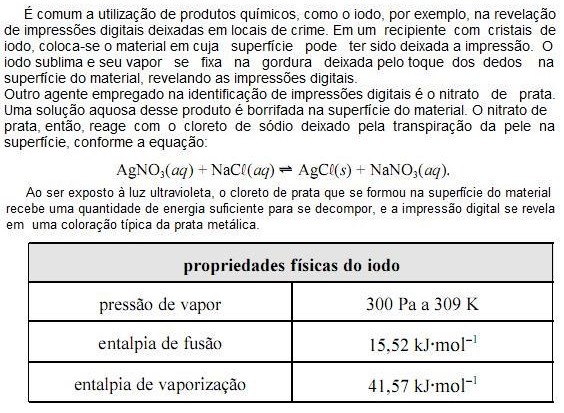
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
O volume molar do vapor de iodo a 309 K é superior a 8,0 m3 mol1
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
A partir das informações do texto, é correto concluir que a reação AgCL(s) ? Ag(s) + ½ CL2(g) é catalisada por luz ultravioleta.