O gás natural veicular (GNV) contido em um tanque de armazenamento ocupa um volume gasoso de 15 m3 e está submetido à pressão de 20 MPa às 6 h, quando a temperatura ambiente, em equilíbrio térmico com o gás, é de 10 °C.
Com relação a essa situação hipotética, julgue os itens seguintes, considerando que todos os gases se comportem idealmente,
que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se o referido GNV for totalmente transferido para outro botijão à mesma temperatura e, nesse novo botijão, a pressão final dos gases for de 30 MPa, então o volume gasoso desse novo botijão será de 10 m3.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
Se a fração molar de metano (CH4) no gás natural for iguala 70%, então, em um botijão de gás natural sob a pressão de 680 kPa, a pressão parcial do metano será superior a 500 kPa.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
A pressão da mistura de hidrogênio e gás natural será igual à soma da pressão parcial do hidrogênio e das pressões parciais dos gases que compuserem o gás natural.
Existe no comércio um produto antimofo constituído por uma embalagem com tampa perfurada contendo cloreto de cálcio anidro, CaCl2. Uma vez aberto o lacre, essa substância absorve a umidade ambiente, transformando-se em cloreto de cálcio di-hidratado, CaCl2 ⋅2H2O.
Considere a massa molar da água igual a 18 g mol−1, e a massa molar do cloreto de cálcio anidro igual a 111 g mol−1.
Na hidratação da substância presente no antimofo, o ganho percentual, em massa, é mais próximo de
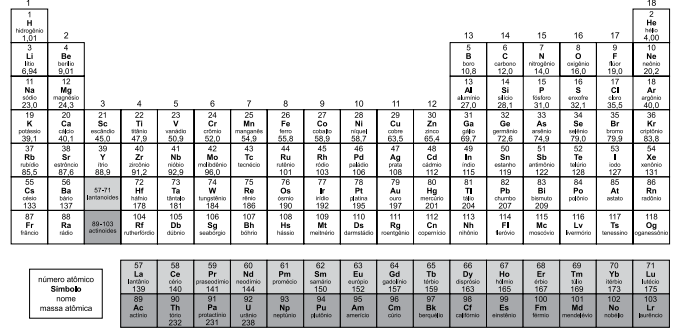
Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Uma amostra contendo 100 mg de uma mistura de carbonato de cálcio e de óxido de cálcio foi analisada por termogravimetria com aquecimento até 800 ºC em atmosfera de ar. A termogravimetria é uma técnica analítica em que a amostra é aquecida em um forno acoplado a uma balança e a massa da amostra é medida durante o aquecimento. Ao término da análise, o resíduo final apresentou a massa constante de 89 mg.
O teor de carbonato de cálcio na amostra analisada corresponde a:

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
A reação do composto As2S5 sólido com uma solução concentrada de HNO3 resulta na formação do gás NO2, de água e dos íons SO42– e AsO4 3–em solução.
Nessa reação, a participação de 1 mol de As2S5 resulta na formação de___________ de moléculas de água e envolve a participação de___________ de elétrons.
As lacunas são preenchidas, correta e respectivamente, por
Assinale o volume aproximado de ácido sulfúrico e os cuidados que devem ser tomados para o preparo de 750 mL de uma solução do ácido a 1,5 mol . L–1, a partir do produto comercial.
(H = 1; S = 32; O = 16; pureza do ácido sulfúrico = 98%; densidade de 1,8 g . mL–1.)
Sabe-se que a reação de combustão completa do acetileno (C2H2(g)) gera CO2(g) e H2O(v). Um aparato para liquefazer o vapor d’água gerado foi montado recuperando 75% da água produzida nessa reação, que foi equivalente à 135 ml de água a temperatura ambiente com densidade de 1,0 g/cm³.
Assinale a alternativa que apresenta a massa do CO2 gerada na reação:
![]()
Para ministrar uma aula experimental, o professor de química precisa preparar 500 mL de solução de Na2SO4 em concentração igual a 0,01 mol/L. Qual deve ser a massa pesada, em gramas, de Na2SO4?
Dados: Massas molares (g/mol) – Na = 23; S = 32; O = 16
A presença de substâncias ricas em enxofre em áreas de mineração provoca preocupantes impactos ambientais. Um exemplo dessas substâncias é a pirita (FeS2), que, em contato com o oxigênio atmosférico, reage formando uma solução aquosa ferruginosa, conhecida como drenagem ácida de minas, segundo a equação química:

Em situações críticas, nas quais a concentração do ácido sulfúrico atinge 9,8 g/L, o pH alcança valores menores que 1,0. Uma forma de reduzir o impacto da drenagem ácida de minas é tratá-la com calcário (CaCO3). Considere que uma amostra comercial de calcário, com pureza igual a 50% em massa, foi disponibilizada para o tratamento.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000 (adaptado).
Qual é a massa de calcário, em gramas, necessária para neutralizar um litro de drenagem ácida de minas, em seu estado crítico, sabendo-se que as massas molares do CaCO3 e do H2SO4 são iguais a 100 g/mol e 98 g/mol, respectivamente?
O número de mols presente em uma amostra de 262g de bicarbonato de sódio (NaHCO3) é aproximadamente
Dado: Massa Molar NaHCO3 = 84g/mol
Um alto explosivo (AE) é um composto cuja detonação é iniciada por calor ou onda de choque, que provoca uma explosão violenta em microssegundos. Um exemplo de AE é o 1,3,5- triamino-2,4,6-trinitrobenzeno (TATB), cuja fórmula é C6H6N6O6. Springall e Robert propuseram um conjunto de regras para predizer os produtos moleculares de uma detonação de explosivos em cuja composição haja carbono, hidrogênio, oxigênio e nitrogênio. A partir dessas regras, é possível descrever os produtos da detonação do composto TATB, de acordo com a equação a seguir.
C6H6N6O6(s) → 3 N2(g) + H2O(g) + CO2(g) + 3 CO(g) +2 H2(g) + C(s)
Considerando-se essas informações e sabendo-se que M (C6H6N6O6) = 258 g/mol, bem como tendo em vista que, em uma detonação, sejam consumidos 516 g de TATB, é correto concluir que a quantidade de matéria de gases liberados nessa reação será igual a
O carbonato de sódio é uma matéria-prima bastante utilizada na fabricação de papel, vidro, sabão e detergentes, sendo normalmente comercializado em sua forma decahidratada
(Na2CO3 . 10H2O).
A massa desse sal, em grama, necessária ao preparo de 250 mL de uma solução aquosa com concentração 0,10 mol.L–1 é, aproximadamente, igual a
[Massas Molares (g.mol–1): H = 1,0; C = 12,0; O = 16,0; Na = 23,0]
A unidade de concentração molar é expressa por
Texto 1A04
A ninidrina (C9H6O4), utilizada em soluções para a revelação de impressões latentes sobre papel e outras superfícies porosas, reage com aminoácidos e outros compostos presentes nas impressões digitais, produzindo um composto de coloração arroxeada. A solução utilizada na perícia criminal, por meio de sua pulverização sobre superfícies, pode ser obtida a partir da dissolução de ninidrina em acetona.
Tendo o texto 1A04 como referência inicial e considerando-se MH = 1,00 g/mol, MC = 12,00 g/mol e MO = 16,00 g/mol, caso se queira preparar 100 mL de uma solução 0,040 mol/L de ninidrina em acetona, a massa de ninidrina a ser dissolvida será igual a