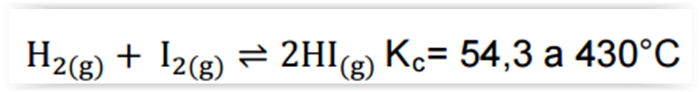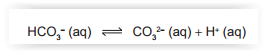Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item a seguir.
Catalisador é a substância ou espécie que aumenta a velocidade de reação, não é consumida e fornece um mecanismo alternativo de baixa energia de ativação para a reação. Um catalisador é capaz de afetar a constante de equilíbrio da reação considerada, por modificar a velocidade da reação direta, aumentando o tempo requerido para o estabelecimento do equilíbrio.
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
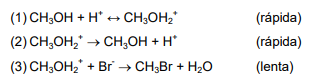
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo de metila, d[CH3Br]/dt, por meio da citada reação.
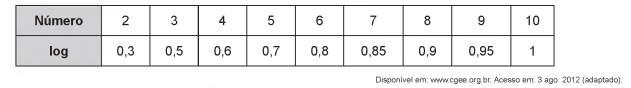
O aproveitamento integral e racional das matérias-primas lignocelulósicas poderá revolucionar uma série de segmentos industriais, tais como o de combustíveis, mediante a produção de bioetanol de segunda geração. Este processo requer um tratamento prévio da biomassa, destacando-se o uso de ácidos minerais diluídos. No pré-tratamento de material lignocelulósico por via ácida, empregou-se uma solução de ácido sulfúrico, que foi preparada diluindo-se 2 000 vezes uma solução de ácido sulfúrico, de concentração igual a 98 g/L, ocorrendo dissociação total do ácido na solução diluída. O quadro apresenta os valores aproximados de logaritmos decimais.
Sabendo-se que as massas molares, em g/mol, dos elementos H, O e S são, respectivamente, iguais a 1, 16 e 32, qual é o pH da solução diluída de ácido sulfúrico preparada conforme descrito?
Atenção: Para responder à questão, considere a curva de titulação abaixo.
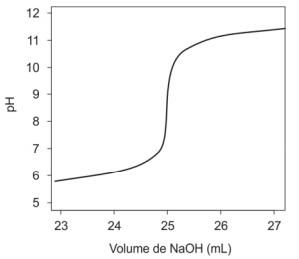
O gráfico representa a titulação de
Considerando-se a reação de formação a seguir, assinalar a alternativa CORRETA:
Com base nos conceitos de equilíbrio químico, julgue os itens
subsequentes.
O equilíbrio químico ocorre quando há um equilíbrio dinâmico entre reagentes e produtos em uma reação química, ou seja, a condição na qual os processos direto e inverso ocorrem simultaneamente em velocidades iguais.
Alguns profissionais burlam a fiscalização quando adicionam quantidades controladas de solução aquosa de hidróxido de sódio a tambores de leite de validade vencida. Assim que o teor de acidez, em termos de ácido lático, encontra-se na faixa permitida pela legislação, o leite adulterado passa a ser comercializado. A reação entre o hidróxido de sódio e o ácido lático pode ser representada pela equação química:
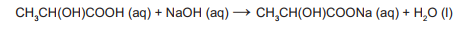
A consequência dessa adulteração é o(a)
Considerando-se a figura a seguir, assinalar a alternativa CORRETA:
Com base nos conceitos de equilíbrio químico, julgue os itens
subsequentes.
Pelo princípio de Le Chatelier, quando uma força é aplicada a um sistema em equilíbrio dinâmico, o equilíbrio tende a se ajustar para minimizar o efeito da força. Um exemplo disso seria o fato de que uma reação no equilíbrio tende a seguir em uma reação endotérmica quando se aumenta a temperatura.
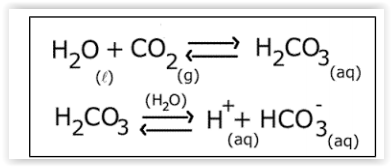
As reações a seguir representam o sistema de
tamponamento sanguíneo do bicarbonato
O aumento no pH sanguíneo resulta
As águas dos oceanos apresentam uma alta concentração de íons e pH entre 8,0 e 8,3. Dentre esses íons estão em equilíbrio as espécies carbonato (CO 32-) e bicarbonato (HC03-), representado pela equação química:
As águas dos rios, ao contrário, apresentam concentrações muito baixas de íons e substâncias básicas, com um pH em torno de 6. A alteração significativa do pH das águas dos rios e oceanos pode mudar suas composições químicas, por precipitação de espécies dissolvidas ou redissolução de espécies presentes nos sólidos suspensos ou nos sedimentos.
A composição dos oceanos é menos afetada pelo lançamento de efluentes ácidos, pois os oceanos
“Quando alguma condição que determina o equilíbrio é
modificada, o sistema responde, no sentido de amenizar a
perturbação sofrida”.
O texto corresponde ao(à):
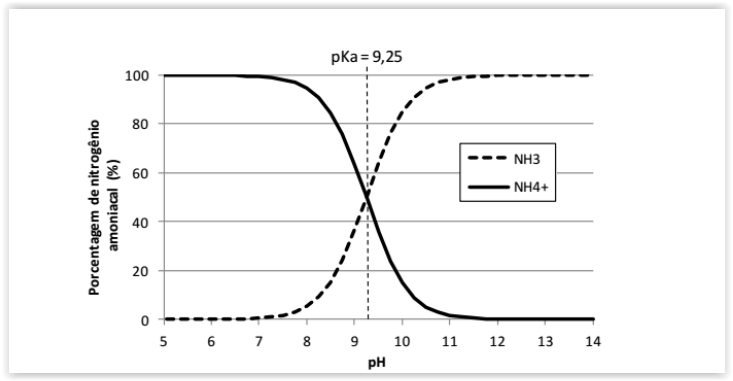
A amônia é um gás incolor à temperatura ambiente e possui um odor
extremamente forte. Seu caráter polar é a principal razão para a sua solubilidade em
água, sendo que em ambientes aquáticos, o nitrogênio amoniacal compreende as
formas do íon amônio (NH4+) e da amônia (NH3) dissolvidos, de maneira que a
proporção entre elas depende da temperatura, salinidade e, principalmente, do pH
do meio.
De acordo com o gráfico acima e os conhecimentos sobre equilíbrio químico.
Assinale a alternativa CORRETA:
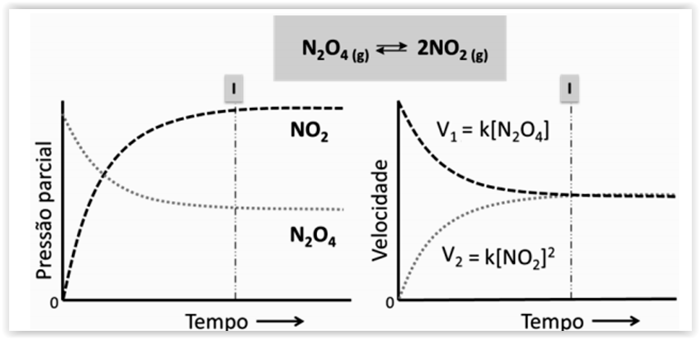
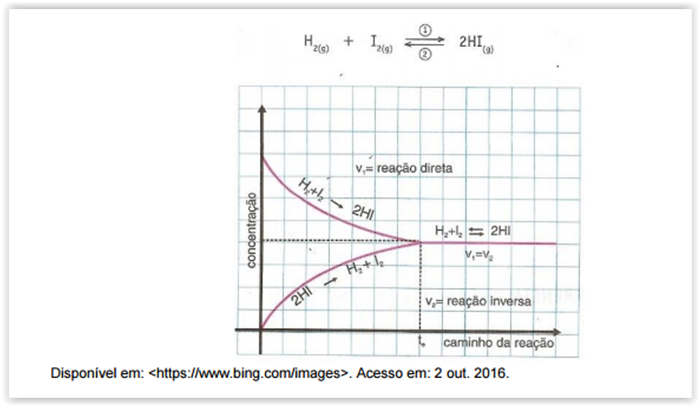
Considere o gráfico a seguir
Por meio da análise do gráfico, é possível destacar que o equilíbrio
Quando PbCl2 sólido é adicionado à água pura à 25°C, o sal dissolve até a concentração de Pb2+ se igualar a 1,57 x 10-2 mol L-1. Após essa concentração, o sólido em excesso permanece insolúvel. Qual o Kps desse sal?