O hidrogênio é um elemento incomum, porque se comporta algumas vezes como os
metais alcalinos e, outras vezes, como um não metal.
Analise as seguintes afirmações a respeito do elemento químico hidrogênio.
I. A afinidade eletrônica do hidrogênio é mais próxima dos valores para os metais
alcalinos do que para os halogênios.
II. O hidrogênio tem menor raio atômico covalente entre quaisquer elementos que
formem compostos químicos.
III. A energia de ionização do hidrogênio é mais próxima dos valores para os metais
alcalinos do que para os halogênios.
A partir dessa análise, conclui–se que estão CORRETAS as afirmativas.
Considere que 0,5 g de uma amostra de sal de cozinha (NaCl) foi dissolvida em água
destilada. Adicionou–se, nessa solução, um excesso de AgNO3, obtendo–se 0,9 g de um
precipitado branco que escurece sob ação da luz.
A partir dessas informações, é CORRETO afirmar que o grau de pureza do sal é
aproximadamente de
Uma solução de 100 mL ácido clorídrico tem pH igual a 1
Após adicionar, em tal solução, 100 mL de uma solução 0,2 mol/L de NaOH, qual será o
novo pH da mistura reacional?
Considere os seguintes dados: log2 = 0,3
A tabela abaixo mostra o nome dos compostos e suas respectivas temperaturas de
ebulição à pressão atmosférica.
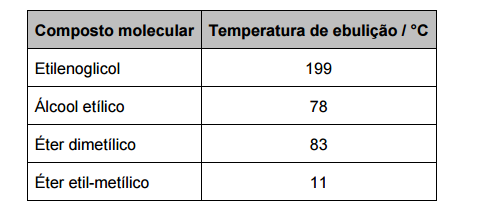
Com relação aos compostos citados, é CORRETO afirmar que
Os tamanhos relativos do quociente da reação Q e da constante de equilíbrio K indicam a
direção para a qual a reação tende a mudar. Para conhecer a tendência de uma
determinada mistura de reagentes e produtos de formar mais produtos ou mais reagentes,
é necessário comparar Q e K.
Com relação às tendências de formar, no equilíbrio, mais produtos ou mais reagentes, é
INCORRETO afirmar que
O composto inter–halogênio BrF3, é um líquido volátil cor palha. O composto exibe
apreciável condutividade elétrica devido à auto–ionização. A equação química abaixo
representa o processo de auto–ionização do BrF3.
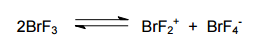
Com relação aos produtos formados (BrF2+ e BrF4–) da auto–ionização do BrF3, suas
estruturas geométricas são, respectivamente,
Uma amostra de 100,0 mL de água foi alcalinizada com amoníaco, e o sulfeto nela
contido foi titulado com 15 mL de AgNO3 0,1 mol/L. A reação analítica é
2Ag+(aq) + S2–(aq) → Ag2S(s)
Considerando–se essas informações, é CORRETO afirmar que a quantidade em massa
de H2S na água é
Uma solução de sacarose (C12H22O11) foi preparada, utilizando 10 g do soluto e 100 g de
água. A pressão de vapor da água pura a 20 ºC é 17 Torr.
A partir dessas informações, é CORRETO afirmar que a pressão de vapor da água na
solução de sacarose a 20 ºC é
São compostos quirais, EXCETO:
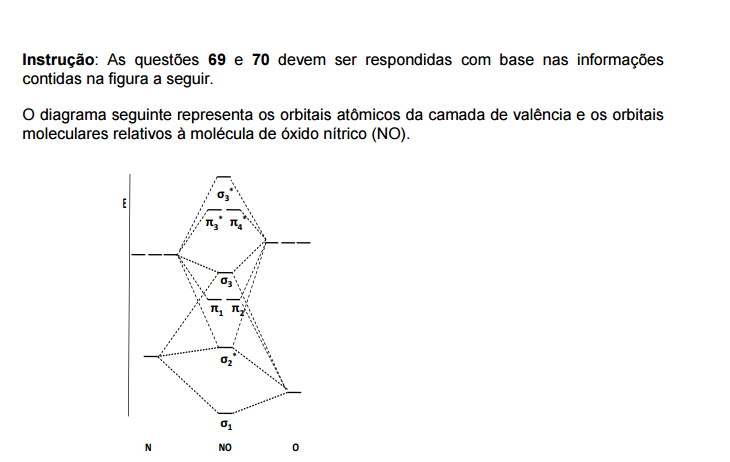
Com base no diagrama e no conhecimento de orbitais moleculares, é CORRETO afirmar
que a ordem de ligação total do NO é
Considere a reação abaixo com o valor da energia livre de Gibbs padrão da reação a
25ºC.
2SO2(g) + O2(g) → 2SO3(g) ΔG0 = –141,74 kJ.mol–1
A partir dessas informações, é CORRETO afirmar que a energia livre de Gibbs de reação,
quando a pressão parcial de cada gás é 100 atm, será
Bohr introduziu um único número quântico para descrever a estrutura eletrônica dos
átomos. A mecânica quântica usa três números quânticos para descrever um orbital.
Numere a COLUNA II de acordo com a COLUNA I, fazendo a relação entre as
informações que podemos obter desses números quânticos e o número quântico
relacionado.

Assinale a alternativa que apresenta a sequência CORRETA.
Um recipiente fechado de 10 litros contém 1 mol de molécula de nitrogênio e 3 mols de
moléculas de hidrogênio a 25 ºC.
Dado: R = 8,2 x 10–2 L.atm.K–1.mol–1
Considerando–se a hipótese de a mistura dos gases ser perfeita, qual é o valor
aproximado da pressão total no interior do recipiente?
Considere uma amostra de gás de moléculas de oxigênio, contida em um recipiente
fechado, mas que se pode controlar o volume. O gás inicialmente nas CNTP é
comprimido para um volume menor à temperatura constante.
Com relação aos efeitos ocasionados pela variação do volume do recipiente, é
INCORRETO afirmar que
À temperatura próxima de 800 °C, o vapor passado sobre o coque (uma forma de carbono
obtida a partir do carvão) quente reage para formar gases de CO e H2.
Observe a seguinte equação química.
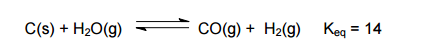
A mistura de gases resultante é um importante combustível industrial chamado gás
d'água.
Dado: R = 0,082 atm.L/mol.K
Se tenho, inicialmente, carbono sólido e 0,1 mol de H2O(g) em um recipiente de 1 L, é
CORRETO afirmar que a pressão parcial de equilíbrio do gás CO é aproximadamente
igual a