Numa cidade em que tempo bom é sinônimo de “vai
dar praia”, proteger a pele dos efeitos nocivos dos
raios ultravioletas (UV) é fundamental. Para isso,
além do protetor solar, também é possível recorrer a
roupas e acessórios com fator de proteção
ultravioleta (FPU), ou seja, feitas à base de dióxido de
titânio (TiO2), componente usado nos protetores
solares, em creme, loção e gel.
Arespeito do dióxido de titânio é correto afirmar:
Os ésteres são usados como essência de frutas e
aromatizantes (flavorizantes) na indústria alimentícia,
farmacêutica e cosméticas. Constituem, também, os
óleos e as gorduras animais e vegetais além de
diversos tipos de cera.
A hidrólise ácida dos ésteres: etanoato de isobutila,
butanoato de butila e etanoato de etila, irá produzir,
respectivamente, os seguintes ácidos carboxílicos:
Considere uma mistura constituída de 0,5 mol de ácido acético (C2H4O2) e 0,5 mol de ácido cianídrico (HCN) em 1 litro de solução. Sabendo que a constante de ionização do ácido acético é 1,8.10-5 , a constante de ionização do ácido cianídrico é 4.10-10 e que a constante de ionização da água vale 10-14 , a concentração, em mol/L de íons H+ e OH- na solução final, após estabelecido o equilíbrio, é igual a:
Um gás inflamável, proveniente de uma garrafa sem
etiqueta, apresenta-se insolúvel em ácido sulfúrico
concentrado. Quando se faz borbulhar o gás em uma
solução aquosa de permanganato de potássio ou em
uma solução de bromo em tetracloreto de carbono,
não se observa qualquer modificação de cor. Uma
amostra de 142 cm3 desse gás recolhida a 20 °C e
1,02 atm tem massa igual a 0,337 g.
Sabendo que o gás é um hidrocarboneto, e supondo
comportamento ideal, é correto afirmar que o referido
gás é o:
Dado: R = 0,082 atm.L.mol-1 .K-1
Em uma célula eletrolítica uma corrente 0,0965 ampères passa durante 1000 segundos através de uma solução 0,1 mol/L de NaCL . A concentração média de íons OH na solução é igual a:
Auma dada temperatura, a solubilidade do carbonato de cálcio (CaCO3) em água é igual a 1 mg/L. A solubilidade desse carbonato em uma solução de carbonato de sódio(Na2CO3) 0,1 mol/Lé igual a:
20 mL de uma amostra de peróxido de hidrogênio
comercial é diluída com água a 250 mL. Uma alíquota
de 25 mL da solução diluída consome, até reação
completa, 41 mL de permanganato de
potássio 0,085N. A concentração da solução original,
em porcentagem de H O , em massa/volume é:
Dado:
KMnO4 +H2O2 +H2SO4 > K2SO4 +H2 SO4+H2O+O2
As aminas são as bases por excelência dentro da
química orgânica, porque o nitrogênio presente em
sua estrutura apresenta par de elétrons disponíveis,
capturando prótons (base de Lewis).
A presença de radical elétron-repelente ligado ao
nitrogênio vai aumentar sua densidade eletrônica,
facilitando a retirada do íon H da molécula de água.
H3 N: + H:OH > NH+4 OH-
Com base no exposto, pode-se afirmar:
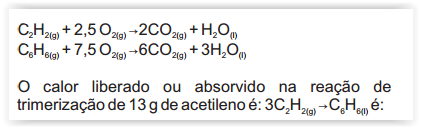
A combustão total de 2,6 g de acetileno (C2H2) libera
130 kJ. A combustão total de 3,9 g de benzeno (C6H6)
libera 165,8 kJ.
Dado:
O rádio é um elemento muito raro, mas sua presença
é facilmente comprovada devido a sua
radioatividade. Como o seu núcleo se desintegra de
forma espontânea, todo rádio provém da fissão
nuclear de elementos mais pesados, principalmente
o urânio.
A meia-vida do isótopo 88Ra226 é igual a 1.620 anos. O
tempo, em anos, necessário para que a atividade de
uma amostra desse isótopo radioativo se reduza em
95% da inicial é:
Um brometo de alquila opticamente ativo e contendo 58,4% de bromo reage completamente com sódio metálico.Assim sendo, o composto obtido será:
0,2 g de uma liga de alumínio e magnésio, reagindo com excesso de ácido clorídrico, produzem 410 cm de gás hidrogênio (H2), medidos a 0,6 atm e 27 °C. Com base nas informações acima, a composição percentual de magnésio e alumínio na liga é, respectivamente, igual a: Dado: R = 0,082 atm.L.mol-1 .K-1 MA:Al = 27u; Mg = 24u
A cabeça de um alfinete de ouro é uma esfera, cujo diâmetro iguala 0,001 cm. O ouro tem massa atômica 197u e uma densidade igual a 19,3 g/L. Considerando π=3 NNúmero de átomos de ouro contido na cabeça do alfinete é aproximadamente igual a:
Uma solução de acetato de sódio (NaC2H3 O2) foi
preparada de modo que sua concentração é
0,1 mol/L.Aequação que representa sua hidrólise é:
C2H4O2-+ H2O > C2H4O2+ OH-
Sabendo-se que:
KC2H4O2 = 1,8.10-5 ; Kw = 1,0.10-14 e log 1,3 = 0,114, o
pH desta solução é:
Os hidrocarbonetos aromáticos, assim como os alcanos, sofrem reações de substituição. O metilbenzeno (tolueno), ao reagir com o cloro (Cl2 ) na presença de luz e calor, fornece como produto: