Ernest Rutherford (1871–1937) foi quem descobriu que, se um núcleo radioativo se desintegra emitindo uma partícula α ou β, o núcleo resultante é, em regra, também radioativo e, mais cedo ou mais tarde, acaba expulsando alguma partícula para converterse em outro núcleo, e assim por diante, até terminar num núcleo estável, isto é, não radioativo. Considere o nuclídeo urânio–238 que, após uma série de emissões, transforma–se no chumbo–206. A quantidade de partículas alfa e beta emitidas nesta série radioativa é, respectivamente, igual a:
Uma mistura gasosa, formada por 1,00 mol de H2O(g) e 1,00 mol de CO(g) é colocada num reator de 10,0L, a 520ºC. A reação H2O(g) + CO(g) ↔ CO2(g) + H2 (g) se processa e verifica–se que, após o equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520ºC, é aproximadamente igual a:
A determinação da concentração de cátions numa solução
pode ser feita através da titulação com um ânion específico, cujos
respectivos sais dos cátions sejam pouco solúveis, mas com solubilidades
distintas entre si, na técnica de “precipitação seletiva".
A ordem de precipitação de carbonatos numa titulação sobre uma
solução contendo concentrações iguais a 0,001 mol.L–1 de Ba2+,
Mn2+, Ag+ e Zn2+ será, do primeiro para o último:

Uma célula galvânica é montada com um eletrodo consistindo
de uma lâmina de zinco metálico imersa em solução aquosa 1,0
mol.L–1 de sulfato de zinco. O outro eletrodo é o de hidrogênio, com
pressão parcial do gás igual a 1 bar e concentração de íons H3O+igual a 0,01 mol.L–1, a 25ºC. A força eletromotriz desta célula, em
volts, é aproximadamente igual a:
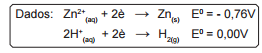
A possibilidade de estabelecimento de ligação entre dois átomos pode ser defi nida em termos de um parâmetro denominado ordem de ligação (O.L), que pode ser determinada a partir do número de elétrons em orbitais ligantes e antiligantes em diagramas de energia dos orbitais, usando–se a Teoria dos Orbitais Moleculares (TOM). Considerando o parâmetro acima citado, a associação correta entre a molécula e sua ordem de ligação está presente em:
A primeira explicação formulada para as ligações existentes
nos compostos de coordenação foi a teoria de coordenação de
Werner (1893). Esta teoria foi desenvolvida antes da descoberta
do elétron e do estabelecimento da teoria eletrônica de valência.
Considere as fórmulas de cinco complexos de metais de transição
mostradas a seguir:
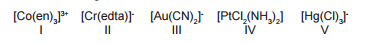
A única opção que apresenta os compostos de coordenação que
têm o mesmo número de coordenação é:

A energia reticular é defi nida como a energia necessária
para dissociar completamente um mol de um composto iônico sólido
em seus íons no estado gasoso. A magnitude da energia reticular
depende das cargas e dos raios dos íons, dentre outros fatores.
Considere os compostos iônicos mostrados a seguir:
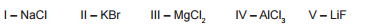
A ordem decrescente de energia reticular dos compostos é:
Algumas propriedades físicas das substâncias, como o ponto
de ebulição e a solubilidade, podem ter suas intensidades previstas
em termos das ligações intermoleculares existentes entre as
moléculas. Considere os compostos orgânicos cujos nomes estão
ordenados a seguir:
I – propan–1–ol
II – etoxietano
III – propanona
IV – propan–2–ol
V – butano
Aquele que apresenta o maior valor de ponto de ebulição é o
composto representado por:
O Índio e o Tálio são os elementos naturais mais pesados do grupo 13 da classifi cação periódica. O Alumínio é o elemento mais conhecido e abundante deste grupo, tendo suas propriedades químicas dominadas pelo estado de oxidação +3, ou seja, forma o íon Al3+. Entretanto, o Índio e oTálio apresentam frequentemente o estado de oxidação +1. A tendência a formar íons com carga duas unidades menor que a usual para o grupo também é verifi cada entre os elementos mais pesados dos grupos 14 e 15, sendo conhecida pelo nome de:
A reação de aldeídos e cetonas com ilídeos de fósforo, conhecida como Reação de Wittig, conferiu o prêmio Nobel de Química de 1979 ao alemão Georg Wittig, que a realizou em 1954. Desde então, tem sido um método muito usado para a síntese de:
O ácido benzoico tem entalpia padrão de combustão igual a
–3227 kJ.mol–1. Para calibrar um calorímetro, foram usados 2,27 g
deste ácido, aumentando em 5,0ºC a temperatura do calorímetro.
Em seguida, com o calorímetro a 25ºC, promoveu–se a queima
de 1,6 g de acetileno (etino) e a temperatura subiu para 31,7ºC. A
entalpia padrão de combustão do acetileno, em kJ.mol–1, é aproximadamente
igual a:

Um dos experimentos mais realizados em aulas de laboratório
de química para alunos do ensino médio é descrito a seguir.
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa
reação, adiciona–se água e obtém–se uma substância A, que torna vermelho
o papel azul de tornassol. Em outro erlenmeyer, faz–se a combustão do
magnésio, adiciona–se água e obtém–se uma substância B, que torna azul
o papel vermelho de tornassol. Em seguida, promove–se a reação entre A
e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
Soluções “tampão" são sistemas químicos muito importantes
na Medicina e Biologia, visto que muitos fl uidos biológicos necessitam
de um pH adequado para que as reações químicas aconteçam
apropriadamente. O plasma sanguíneo é um exemplo de um meio
tamponado, que resiste a variações bruscas de pH quando se
adicionam pequenas quantidades de ácidos ou bases. Considere
uma solução “tampão" preparada pela adição de 100 mL de solução
0,01 mol.Lsup>–1 de ácido acético a 100 mL de solução 0,1 mol.L–1 de
acetato de sódio. O pH deste “tampão" é aproximadamente igual a:

A Daptomicina é um lipopeptídeo cíclico isolado do fungo
Streptomyces roseosporus, que apresenta elevada atividade sobre
bactérias resistentes. Este antibiótico foi recentemente aprovado
pelo US–FDA para tratamento de infecções cutâneas graves, sendo
comercializado pelo nome de Cubicin. Sua estrutura é mostrada
a seguir:
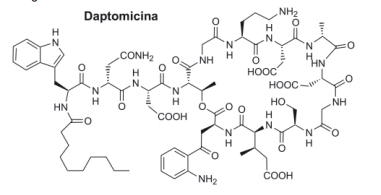
Algumas das funções orgânicas presentes na estrutura da Daptomicina
são:
Em 2008, o Brasil foi o terceiro maior extrator de bauxita
(minério) no mundo, o quarto maior produtor de alumina (óxido
de alumínio) e o sexto maior produtor de alumínio metálico. A obtenção
do metal a partir do óxido é feita por eletrólise ígnea, após
a separação da alumina das impurezas através do “processo de
Bayer", que é a reação com soda cáustica. Em seguida, ocorre a
adição de “criolita", um mineral que atua como fundente, diminuindo
o ponto de fusão de 2072ºC para cerca de 1000ºC. Finalmente,
ocorre a eletrólise, com eletrodos (não inertes) de grafi te (C). Um
processo eletrolítico de alumínio ocorre durante 12h, utilizando uma
corrente de 100 ampères (A). A massa aproximada, em gramas,
de metal obtido no cátodo e a substância produzida no ânodo são,
respectivamente:


